Objectivos
Após concluir esta secção, deverá ser capaz de
- escrever uma equação para a hidrogenação catalítica de um alceno.
- identificar o produto obtido da hidrogenação de um determinado alceno.
- identificar o alceno, os reagentes, ou ambos, necessários para preparar um determinado alcano por hidrogenação catalítica.
- descrever o mecanismo da hidrogenação catalítica de alcenos.
- explicar a diferença entre uma reação heterogénea e uma reação homogénea.
- reconhecer que outros tipos de compostos com ligações múltiplas, como as cetonas, os ésteres, as nitrilas e os compostos aromáticos, não reagem com o hidrogénio nas condições utilizadas para hidrogenar os alcenos.
Termos-chave
Certifica-te de que sabes definir e utilizar no contexto os termos-chave que se seguem.
- O catalisador de Adams
- hidrogenação
Notas de estudo
As reacções químicas heterogéneas têm reagentes que se encontram em pelo menos duas fases diferentes (por exemplo, gás com um sólido), enquanto as reacções homogéneas ocorrem numa única fase (por exemplo, gás com outro gás).
A descrição do catalisador utilizado na reação entre alcenos e hidrogénio pode gerar alguma confusão. Três metais - níquel, platina e paládio - são normalmente utilizados, mas um químico não pode simplesmente colocar um pedaço de um destes metais numa mistura de alceno e hidrogénio e obter uma reação. Cada catalisador metálico tem de ser preparado de uma forma especial:
- O níquel é normalmente utilizado numa forma finamente dividida chamada "níquel Raney". É preparado pela reação de uma liga de Ni-Al com NaOH.
- O paládio é obtido comercialmente "suportado" numa substância inerte, como o carvão, (Pd/C). O alceno é geralmente dissolvido em etanol quando o Pd/C é utilizado como catalisador.
- a platina é utilizada como PtO 2 O hidrogénio utilizado para adicionar à ligação dupla carbono-carbono reduz igualmente o óxido de platina(IV) a platina metálica finamente dividida. O etanol ou o ácido acético é utilizado como solvente para o alceno.
Outros tipos de compostos com ligações múltiplas, tais como cetonas, ésteres e nitrilos, não reagem com o hidrogénio nas condições utilizadas para hidrogenar alcenos. Os exemplos abaixo mostram a redução de um alceno, mas os grupos cetona e nitrilo presentes permanecem intactos e não são reduzidos.
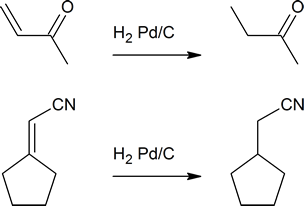
Os anéis aromáticos também não são reduzidos nas condições utilizadas para reduzir os alcenos, embora estes anéis pareçam conter três ligações duplas carbono-carbono. Como verá mais adiante, os anéis aromáticos não contêm realmente quaisquer ligações duplas, e muitos químicos preferem representar o anel de benzeno como um hexágono com um círculo no seu interior
em vez de um hexágono com três ligações duplas alternadas.
A representação do anel de benzeno será discutida mais adiante na Secção 15.2.
A reação entre ligações duplas carbono-carbono e hidrogénio fornece um método para determinar o número de ligações duplas presentes num composto. Por exemplo, uma mole de ciclo-hexeno reage com uma mole de hidrogénio para produzir uma mole de ciclo-hexano:
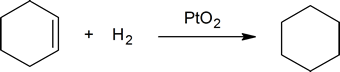
mas uma mole de 1,4-ciclohexadieno reage com duas moles de hidrogénio para formar uma mole de ciclohexano:
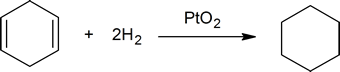
Um químico diria que o ciclo-hexeno reage com um equivalente de hidrogénio e que o 1,4-ciclo-hexadieno reage com dois equivalentes de hidrogénio. Se pegar numa quantidade conhecida de um hidrocarboneto insaturado desconhecido e determinar a quantidade de hidrogénio que este absorve, pode facilmente determinar o número de ligações duplas presentes no hidrocarboneto (ver pergunta 2, abaixo).
A adição de hidrogénio a uma ligação dupla carbono-carbono é designada por hidrogenação. O efeito global desta adição é a remoção redutora do grupo funcional da ligação dupla. A regiosselectividade não é um problema, uma vez que o mesmo grupo (um átomo de hidrogénio) está ligado a cada um dos carbonos da ligação dupla. A fonte mais simples de dois átomos de hidrogénio é o hidrogénio molecular (H 2 Embora a reação global de hidrogenação seja exotérmica, uma energia de ativação elevada impede-a de ocorrer em condições normais. Esta restrição pode ser contornada através da utilização de um catalisador, como se mostra no diagrama seguinte.
Numa reação de hidrogenação, dois átomos de hidrogénio são adicionados através da ligação dupla de um alceno, resultando num alcano saturado. A hidrogenação de uma ligação dupla é uma reação termodinamicamente favorável porque forma um produto mais estável (de menor energia). Por outras palavras, a energia do produto é inferior à energiaO calor libertado é designado por calor de hidrogenação, que é um indicador da estabilidade de uma molécula.

Os catalisadores são substâncias que alteram a taxa (velocidade) de uma reação química sem serem consumidos ou aparecerem como parte do produto. Os catalisadores actuam diminuindo a energia de ativação das reacções, mas não alteram a energia potencial relativa dos reagentes e dos produtos. Os metais finamente divididos, como a platina, o paládio e o níquel, estão entre os catalisadores de hidrogenação mais utilizadosA hidrogenação catalítica processa-se em, pelo menos, duas fases, como se mostra no diagrama. Em primeiro lugar, o alceno deve ser adsorvido na superfície do catalisador juntamente com uma parte do hidrogénio. Em seguida, dois hidrogénios deslocam-se da superfície do metal para os carbonos da ligação dupla, e o hidrocarboneto saturado resultante, que está mais fracamente adsorvido, deixa a superfície do catalisador. A natureza exactae o momento dos últimos acontecimentos não são bem conhecidos.
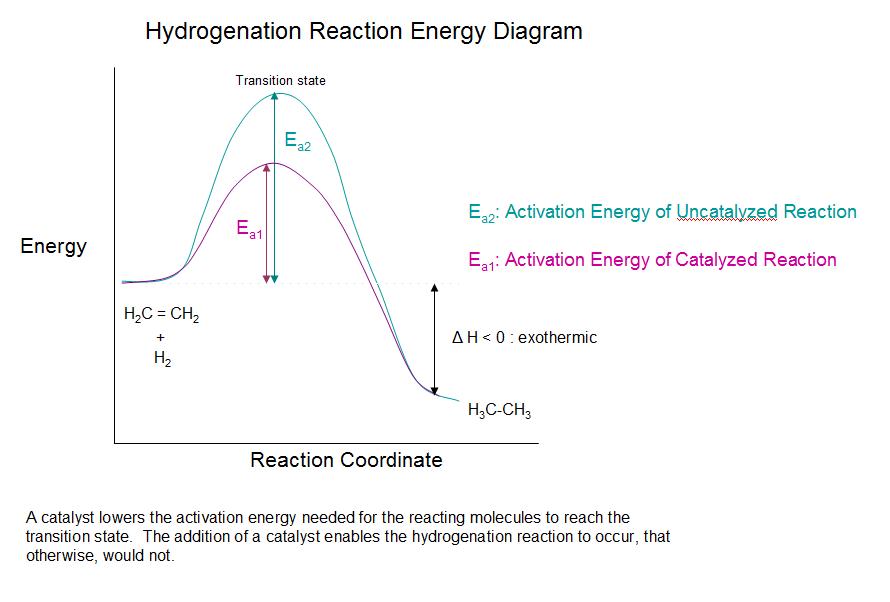
Como mostra o diagrama de energia, a hidrogenação dos alcenos é exotérmica, sendo libertado o calor correspondente ao ΔE (de cor verde) no diagrama. Este calor de reação pode ser utilizado para avaliar a estabilidade termodinâmica dos alcenos com diferentes números de substituintes alquilo na ligação dupla. Por exemplo, a tabela seguinte apresenta os calores de hidrogenação de três alcenos C 5 H 10 Uma vez que um grande calor de reação indica um reagente de alta energia, estes calores são inversamente proporcionais às estabilidades dos isómeros do alceno. Por aproximação, vemos que cada substituinte alquilo numa ligação dupla estabiliza este grupo funcional em pouco mais de 1 kcal/mol.
| Isómero de alceno | (CH 3 ) 2 CHCH=CH 2 3-metil-1-buteno | CH 2 =C(CH 3 )CH 2 CH 3 2-metil-1-buteno | (CH 3 ) 2 C=CHCH 3 2-metil-2-buteno |
|---|---|---|---|
| Calor de reação ( ΔHº ) | -30,3 kcal/mole | -28,5 kcal/mole | -26,9 kcal/mole |

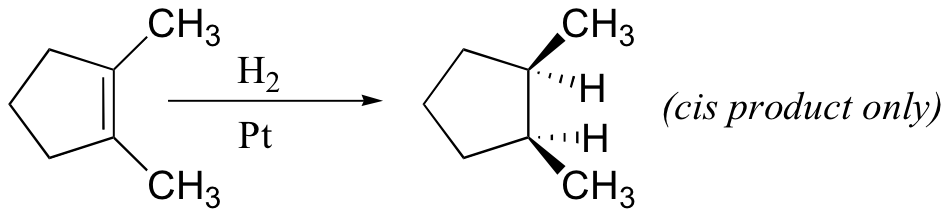
A partir do mecanismo aqui apresentado, seria de esperar que a adição de hidrogénio ocorresse com estereosselectividade sintética, o que é frequentemente verdade, mas os catalisadores de hidrogenação podem também causar isomerização da ligação dupla antes da adição de hidrogénio, caso em que a estereosselectividade pode ser incerta.