- Objectivos
- Termos-chave
- Notas de estudo
- Definição de Brønsted-Lowery
- Os ácidos são doadores de protões e as bases são aceitadores de protões
- Exemplos
- Perguntas
- Respostas
- Conjugação de pares ácido-base
Objectivos
Após concluir esta secção, deverá ser capaz de
- apresentar a definição de Brønsted-Lowry de um ácido e de uma base.
- identificar o ácido e a base de Brønsted-Lowry numa dada reação ácido-base.
Termos-chave
Certifica-te de que sabes definir e utilizar no contexto os termos-chave que se seguem.
- ácido (Brønsted-Lowry)
- base (Brønsted-Lowry)
- ácido conjugado
- base conjugada
Notas de estudo
Deve estar familiarizado com o conceito de acidez de Brønsted-Lowry e com as diferenças entre ácidos fortes e ácidos fracos. Pode querer rever este tópico antes de continuar.
Em 1923, os químicos Johannes Brønsted e Martin Lowry desenvolveram, de forma independente, definições de ácidos e bases baseadas na capacidade dos compostos para doar ou aceitar protões (iões H+). Neste caso, os ácidos são definidos como sendo capazes de doar protões sob a forma de iões de hidrogénio, enquanto as bases são definidas como sendo capazes de aceitar protões.mais tempo necessário para estar presente na solução para que ocorram reacções de ácido e base.
Definição de Brønsted-Lowery
J.N. Brønsted e T.M. Lowry desenvolveram independentemente a teoria dos dadores de protões e dos receptores de protões nas reacções ácido-base, coincidentemente na mesma região e durante o mesmo ano. A teoria de Arrhenius, em que os ácidos e as bases são definidos pelo facto de a molécula conter ou não hidrogénio e ião hidróxido, é demasiado limitadora. O principal efeito da definição de Brønsted-Lowry é identificar o protão (H+)Isto é melhor ilustrado na seguinte equação:
HA+Z⇌A-+HZ+| Ácido | Base | |
| Doa iões de hidrogénio | Aceita iões de hidrogénio. | |
| HCl+ | HOH → | H 3 O+ + Cl- |
| HOH+ | NH 3 → | NH 4 + + OH- |
A determinação de uma substância como ácido ou base de Brønsted-Lowery só pode ser feita através da observação da reação. No caso do HOH, é uma base no primeiro caso e um ácido no segundo caso.
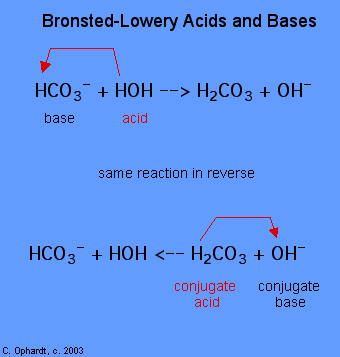
Para determinar se uma substância é um ácido ou uma base, conte os hidrogénios de cada substância antes e depois da reação. Se o número de hidrogénios tiver diminuído, essa substância é um ácido (doa iões de hidrogénio). Se o número de hidrogénios tiver aumentado, essa substância é uma base (aceita iões de hidrogénio). Estas definições são normalmente aplicadas aos reagentes à esquerda. Se a reação forAs substâncias do lado direito da equação são designadas por ácido conjugado e base conjugada, em comparação com as do lado esquerdo. Observe também que o ácido original se transforma em base conjugada após o fim da reação.
Os ácidos são doadores de protões e as bases são aceitadores de protões
Para que uma reação esteja em equilíbrio, é necessário que ocorra uma transferência de electrões. O ácido cede um eletrão e a base recebe o eletrão. Os ácidos e as bases que funcionam em conjunto desta forma são designados por par conjugado constituído por ácidos conjugados e bases conjugadas .HA+Z⇌A-+HZ+
A representa um composto ácido e Z representa um composto básico
- A Doa H para formar HZ+.
- Z aceita H de A, formando HZ+
- A- torna-se a base conjugada do HA e, na reação inversa, aceita um H do HZ para recriar o HA, de modo a permanecer em equilíbrio
- O HZ+ torna-se um ácido conjugado do Z e, na reação inversa, doa um H ao A-, recriando o Z para se manter em equilíbrio
Exemplos
Perguntas
- Porque é que o HA é um ácido?
- Porque é que A- é uma Base?
- Como é que A- pode ser uma base quando HA era um ácido?
- Como é que o HZ+ pode ser um ácido se o Z era uma base?
- Agora que compreendemos o conceito, vamos ver um exemplo com compostos reais! HCl+H2O⇌H3O++Cl¯
- O HCL é o ácido porque está a doar um protão ao H 2 O
- H 2 O é a base porque o H 2 O está a aceitar um protão do HCL
- H 3 O+ é o ácido conjugado porque está a doar um ácido ao CL, transformando-o no seu ácido conjugado H 2 O
- Cl¯ é a base conjugada porque aceita um H do H 3 O para regressar ao seu ácido conjugado HCl
Como pode H 2 O ser uma base? Pensei que era neutro?
Respostas
Mostrar resposta 1. Tem um protão que pode ser transferido2. recebe um protão do HA
3. o A- é uma base conjugada porque necessita de um H para se manter em equilíbrio e regressar a HA
4. o HZ+ é um ácido conjugado porque precisa de doar ou ceder o seu protão para voltar ao seu estado anterior de Z
5) Na teoria de Brønsted-Lowry, o que faz de um composto um elemento ou uma base é o facto de doar ou aceitar protões. Se o H2O estivesse num problema diferente e doasse um H em vez de aceitar um H, seria um ácido!
Conjugação de pares ácido-base
Discutimos o conceito de pares conjugados ácido-base no Capítulo 4, utilizando como exemplo a reação do amoníaco, a base, com a água, o ácido. Em soluções aquosas, os ácidos e as bases podem ser definidos em termos da transferência de um protão de um ácido para uma base. Assim, para cada espécie ácida numa solução aquosa, existe uma espécie derivada do ácido pela perda de um protão. Estas duasAs espécies que diferem apenas por um protão constituem um par ácido-base conjugado. Por exemplo, na reação de HCl com água (Equação 16.1), HCl O ácido parental doa um protão a uma molécula de água, a base parental, formando assim Cl- . assim Cl e Cl- Por convenção, escrevemos sempre um par conjugado ácido-base como o ácido seguido da sua base conjugada. Na reação inversa, o Cl - O ião em solução actua como uma base para aceitar um protão de H 3 O+ , formando H 2 O e HCl. Assim H 3 O+ e H 2 O Em geral, qualquer reação ácido-base deve conter dois pares ácido-base conjugados, que neste caso são HCl/Cl- e H 3 O+/H 2 O .
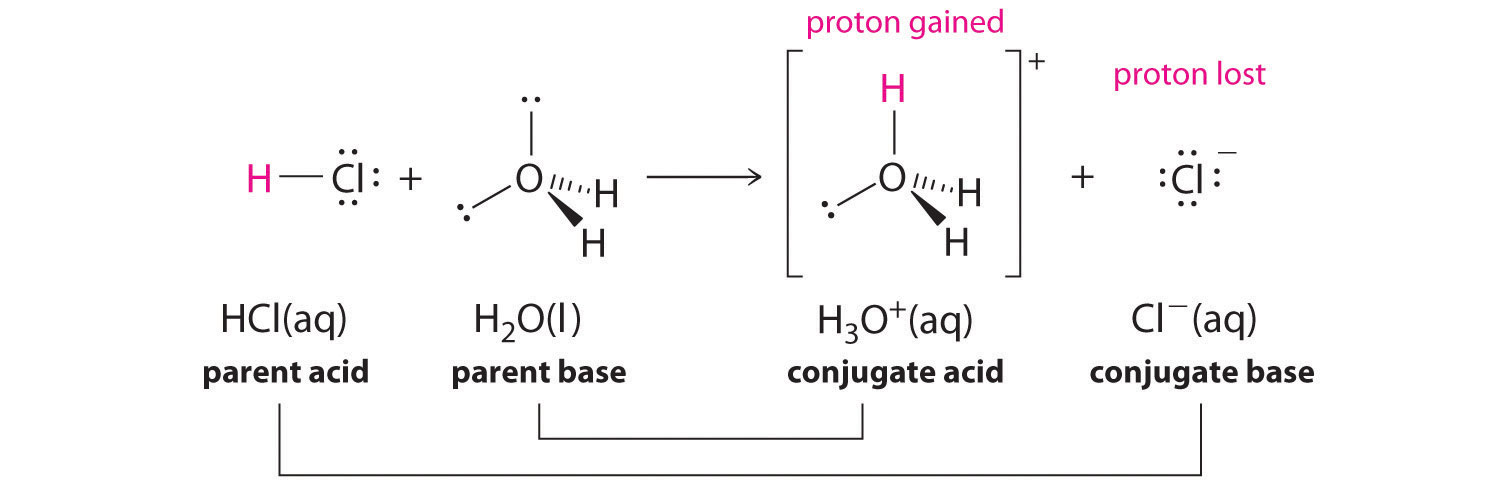
Nota
Todas as reacções ácido-base contêm dois pares ácido-base conjugados.
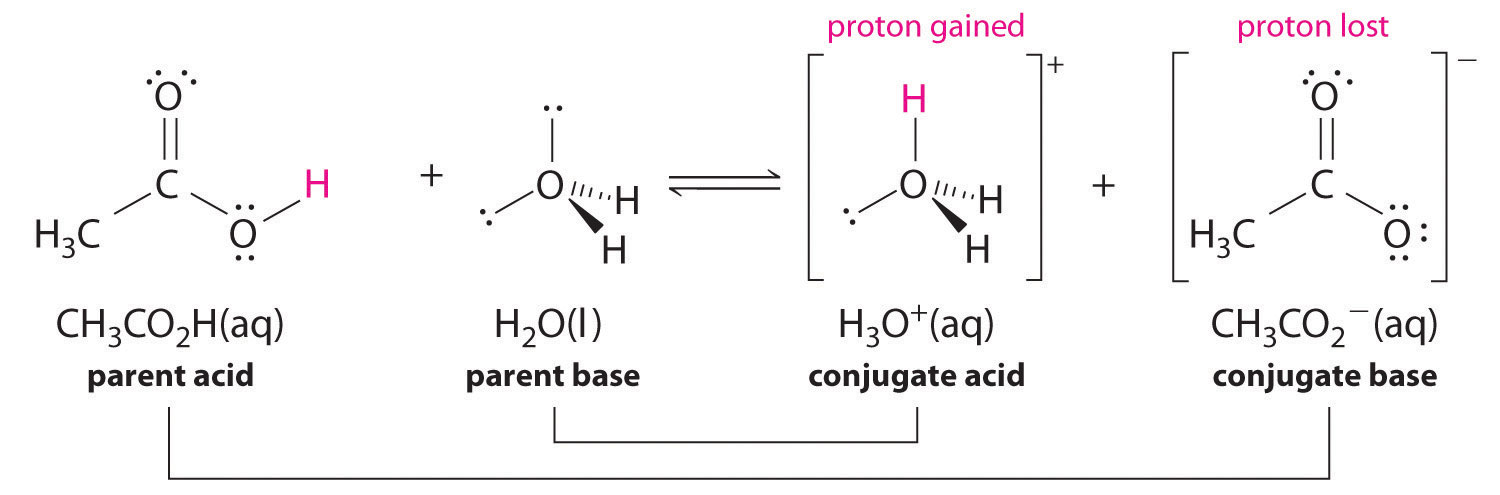
Da mesma forma, na reação do ácido acético com a água, o ácido acético doa um protão à água, que actua como base. Na reação inversa, H 3 O+ Mais uma vez, temos dois pares conjugados ácido-base: o ácido parental e a sua base conjugada ( CH 3 CO 2 H/CH 3 CO 2 - ) e a base-mãe e o seu ácido conjugado ( H 3 O+/H 2 O ).
Na reação do amoníaco com a água para dar iões amónio e iões hidróxido (Equação 16.3), o amoníaco actua como uma base ao aceitar um protão de uma molécula de água, o que neste caso significa que a água está a atuar como um ácido. Na reação inversa, um ião amónio actua como um ácido ao doar um protão a um ião hidróxido, e o ião hidróxido actua como uma base.reação são NH 4 +/NH 3 e H 2 O/OH- Alguns pares ácido-base conjugados comuns são apresentados na Figura 2.7.1.
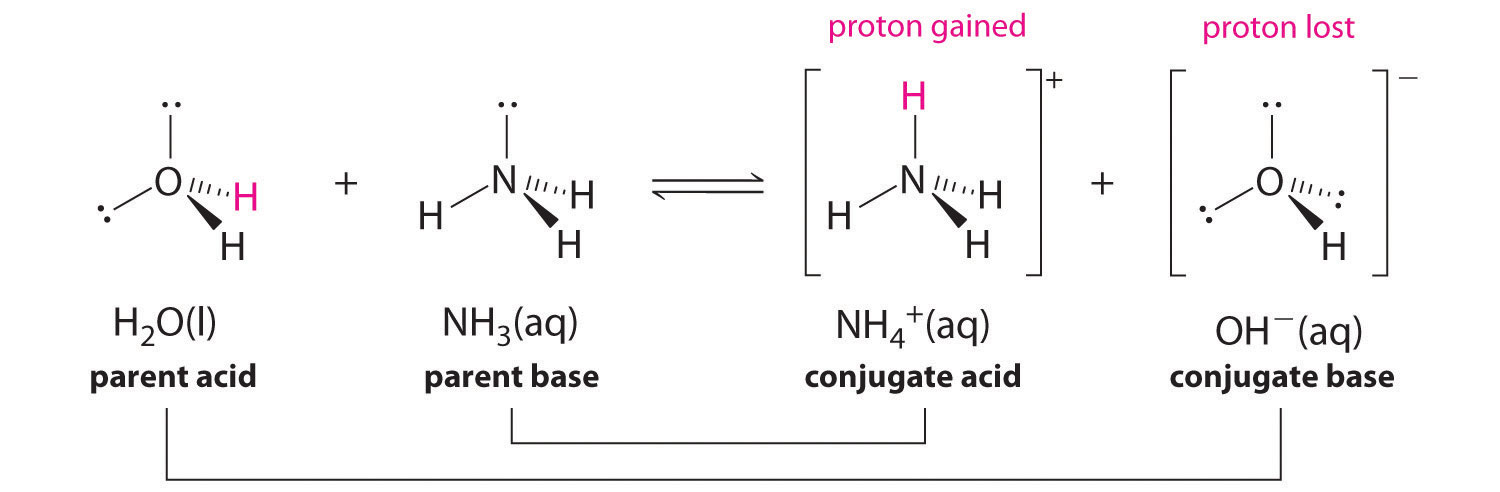
Figura 1: A força relativa de alguns pares ácido-base conjugados comuns
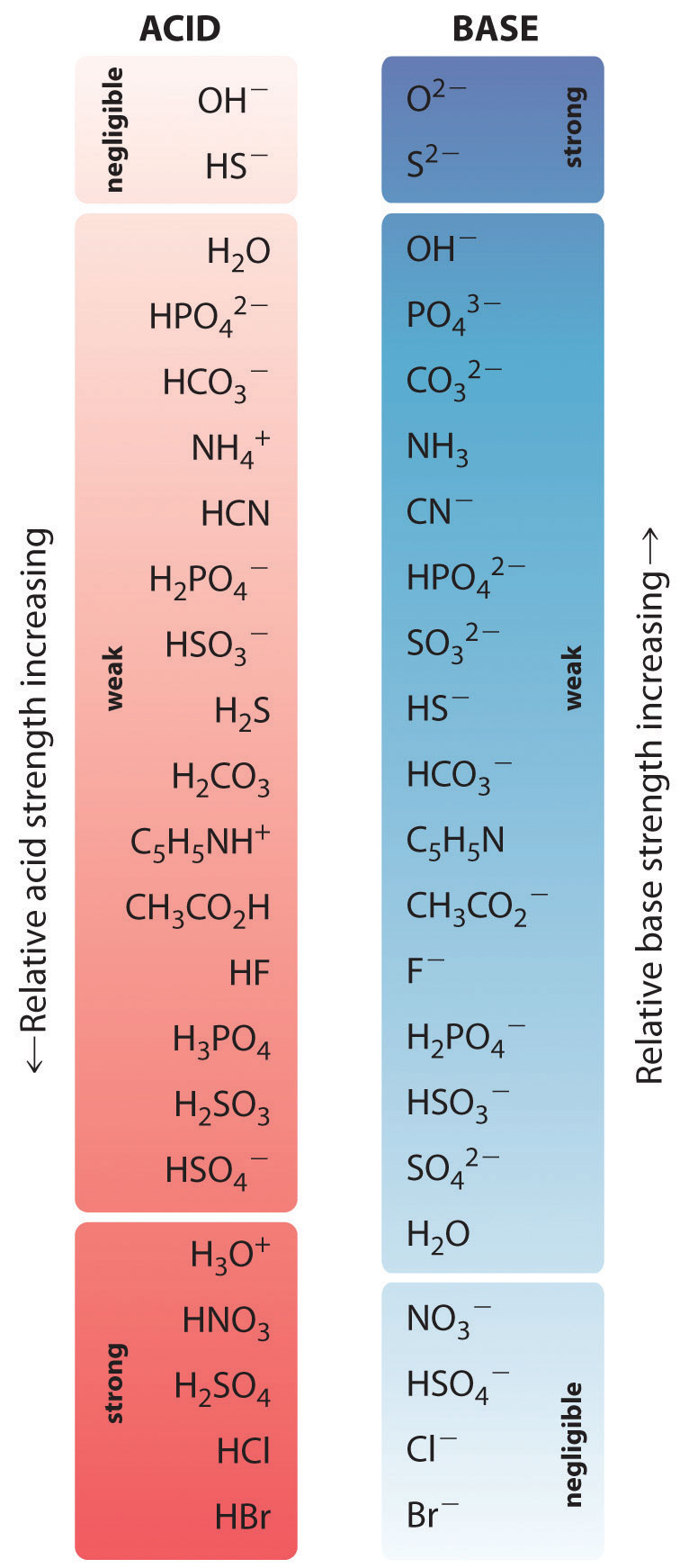
A base conjugada de um ácido forte é uma base muito fraca e, inversamente, o ácido conjugado de uma base forte é um ácido muito fraco.