Identificar os blocos de construção da matéria
No seu nível mais fundamental, a vida é feita de matéria. Matéria é qualquer substância que ocupa espaço e tem massa. Elementos são formas únicas de matéria com propriedades químicas e físicas específicas que não podem ser decompostas em substâncias mais pequenas através de reacções químicas normais. Existem 118 elementos, mas apenas 92 ocorrem naturalmente. Os restantes elementos são sintetizados em laboratório e são instáveis.
Cada elemento é designado pelo seu símbolo químico, que é uma única letra maiúscula ou, quando a primeira letra já está "ocupada" por outro elemento, uma combinação de duas letras. Alguns elementos seguem o termo inglês para o elemento, como C para carbono e Ca para cálcio. Os símbolos químicos de outros elementos derivam dos seus nomes latinos; por exemplo, o símbolo para o sódio é Na, referindo-se a natrium , a palavra latina para sódio.
Os quatro elementos comuns a todos os organismos vivos são o oxigénio (O), o carbono (C), o hidrogénio (H) e o azoto (N). No mundo não vivo, os elementos encontram-se em diferentes proporções, e alguns elementos comuns aos organismos vivos são relativamente raros na Terra como um todo, como mostra o Quadro 1. Por exemplo, a atmosfera é rica em azoto e oxigénio, mas contém pouco carbono e hidrogénio, enquanto aA crosta terrestre, embora contenha oxigénio e uma pequena quantidade de hidrogénio, tem pouco azoto e carbono. Apesar das suas diferenças de abundância, todos os elementos e as reacções químicas entre eles obedecem às mesmas leis químicas e físicas, independentemente de fazerem parte do mundo vivo ou não vivo.
| Tabela 1: Percentagem aproximada de elementos nos organismos vivos (humanos) em comparação com o mundo não vivo | |||
|---|---|---|---|
| Elemento | Vida (Humanos) | Atmosfera | Crosta terrestre |
| Oxigénio (O) | 65% | 21% | 46% |
| Carbono (C) | 18% | traço | traço |
| Hidrogénio (H) | 10% | traço | 0.1% |
| Azoto (N) | 3% | 78% | traço |
Objectivos de aprendizagem
- Desenhar um diagrama de um átomo, de acordo com os conhecimentos científicos actuais
- Compreender a tabela periódica dos elementos e como utilizá-la para compreender os elementos
- Descrever o comportamento e a localização dos electrões, e como estes factores influenciam a formação de ligações entre átomos
Átomos
A estrutura do átomo
Para compreender como é que os elementos se juntam, temos primeiro de discutir o componente mais pequeno ou o bloco de construção de um elemento, o átomo. átomo é a mais pequena unidade de matéria que retém todas as propriedades químicas de um elemento. Por exemplo, um átomo de ouro tem todas as propriedades do ouro, na medida em que é um metal sólido à temperatura ambiente. Uma moeda de ouro é simplesmente um número muito grande de átomos de ouro moldados na forma de uma moeda e contendo pequenas quantidades de outros elementos conhecidos como impurezas. Os átomos de ouro não podem ser decompostos emqualquer coisa mais pequena, mantendo as propriedades do ouro.
Um átomo é composto por duas regiões: o núcleo Os átomos contêm protões, electrões e neutrões, entre outras partículas subatómicas. A única exceção é o hidrogénio (H), que é constituído por um protão e um eletrão, sem neutrões.
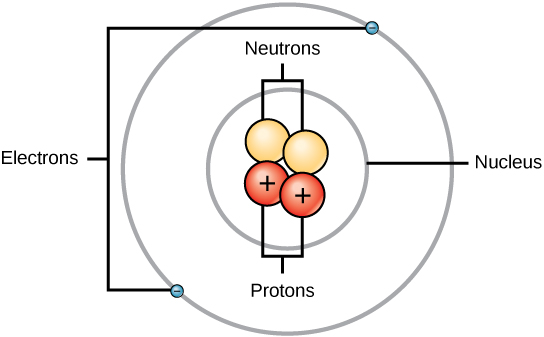
Os átomos são constituídos por protões e neutrões localizados no núcleo, com electrões em orbitais à volta do núcleo.
Os protões e os neutrões têm aproximadamente a mesma massa, cerca de 1,67 × 10-24 gramas. Os cientistas definem arbitrariamente esta quantidade de massa como uma unidade de massa atómica (amu) ou um Dalton, como mostra a Tabela 1. Embora semelhantes em massa, os protões e os neutrões diferem na sua carga eléctrica. protão tem carga positiva, enquanto que um neutrões Por conseguinte, o número de neutrões de um átomo contribui significativamente para a sua massa, mas não para a sua carga. Electrões são muito mais pequenos em massa do que os protões, pesando apenas 9,11 × 10-28 gramas, ou cerca de 1/1800 de uma unidade de massa atómica. Por conseguinte, não contribuem muito para a massa atómica total de um elemento. Assim, quando se considera a massa atómica, é habitual ignorar a massa de quaisquer electrões e calcular a massa do átomo com base apenas no número de protões e neutrões.Nos átomos neutros e sem carga, o número de electrões que orbitam o núcleo é igual ao número de protões no interior do núcleo. Nestes átomos, as cargas positivas e negativas anulam-se mutuamente, resultando num átomo sem carga líquida.
Tendo em conta os tamanhos dos protões, neutrões e electrões, a maior parte do volume de um átomo - mais de 99% - é, de facto, espaço vazio. Com todo este espaço vazio, pode perguntar-se porque é que os chamados objectos sólidos não passam uns pelos outros. A razão pela qual não passam é porque os electrões que rodeiam todos os átomos têm carga negativa e as cargas negativas repelem-se mutuamente.
| Tabela 1: Protões, Neutrões e Electrões | |||
|---|---|---|---|
| Carga | Massa (amu) | Localização | |
| Protão | +1 | 1 | núcleo |
| Neutrões | 0 | 1 | núcleo |
| Eletrão | -1 | 0 | orbitais |
Número atómico e massa
Os átomos de cada elemento contêm um número caraterístico de protões e de electrões. O número de protões determina a número atómico O número de neutrões é variável, resultando em isótopos, que são diferentes formas do mesmo átomo que variam apenas no número de neutrões que possuem. Em conjunto, o número de protões e o número de neutrões determinam o número de massa de um elemento, como ilustrado na Figura 2. Note-se que a pequena contribuição de massa dos electrões éEsta aproximação da massa pode ser usada para calcular facilmente quantos neutrões um elemento tem, simplesmente subtraindo o número de protões do número de massa. Uma vez que os isótopos de um elemento terão números de massa ligeiramente diferentes, os cientistas também determinam o massa atómica Por exemplo, a massa atómica do cloro (Cl) é 35,45 porque o cloro é composto por vários isótopos, alguns (a maioria) com massa atómica 35 (17 protões e 18 neutrões) e outros com massa atómica 37 (17 protões e 20 neutrões).
Pergunta prática
O carbono tem um número atómico de seis e dois isótopos estáveis com números de massa de doze e treze, respetivamente. A sua massa atómica é 12,11.
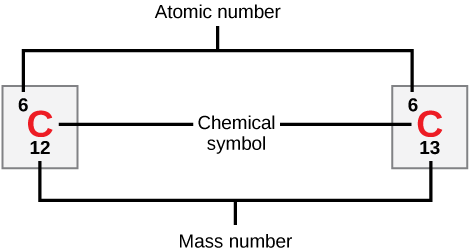
Figura 2. Carbono-12 e carbono-13
Quantos neutrões têm o carbono-12 e o carbono-13, respetivamente?
Mostrar resposta O carbono-12 tem seis neutrões e o carbono-13 tem sete neutrões.A Tabela Periódica dos Elementos
Os diferentes elementos estão organizados e representados na tabela periódica. Concebida pelo químico russo Dmitri Mendeleev (1834-1907) em 1869, a tabela agrupa elementos que, embora únicos, partilham certas propriedades químicas com outros elementos. As propriedades dos elementos são responsáveis pelo seu estado físico à temperatura ambiente: podem ser gases, sólidos ou líquidos. Os elementos também têm propriedadesreatividade química, a capacidade de se combinarem e de se ligarem quimicamente entre si.
Na tabela periódica, apresentada na Figura 3, os elementos são organizados e apresentados de acordo com o seu número atómico e estão dispostos numa série de linhas e colunas com base nas propriedades químicas e físicas comuns. Para além de fornecer o número atómico de cada elemento, a tabela periódica apresenta também a massa atómica do elemento. Se olharmos para o carbono, por exemplo, aparece o seu símbolo (C) e o seu nome,bem como o seu número atómico de seis (no canto superior esquerdo) e a sua massa atómica de 12,11.
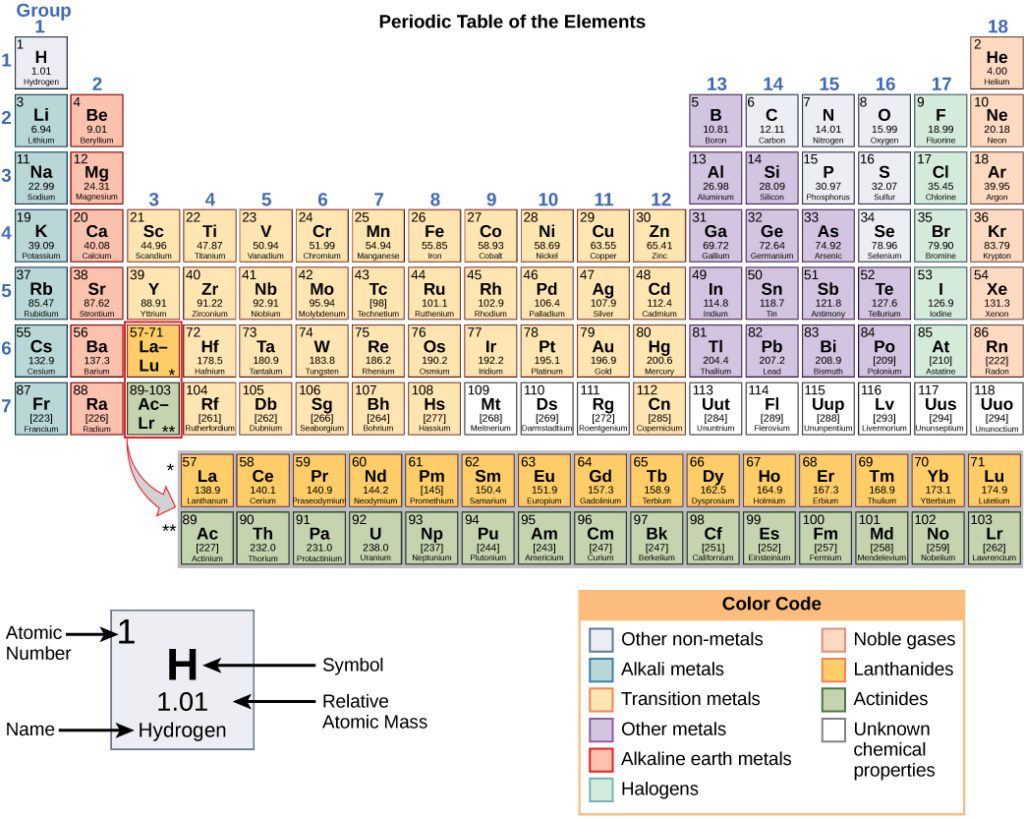
Figura 3 - A tabela periódica mostra a massa atómica e o número atómico de cada elemento. O número atómico aparece por cima do símbolo do elemento e a massa atómica aproximada aparece por baixo.
A tabela periódica agrupa os elementos de acordo com as suas propriedades químicas. As diferenças de reatividade química entre os elementos baseiam-se no número e na distribuição espacial dos electrões de um átomo. Os átomos que reagem quimicamente e se ligam uns aos outros formam moléculas. As moléculas são simplesmente dois ou mais átomos ligados quimicamente entre si. Logicamente, quando dois átomos se ligam quimicamente para formar uma molécula,os seus electrões, que formam a região mais externa de cada átomo, juntam-se primeiro quando os átomos formam uma ligação química.
Veja este vídeo para uma introdução mais aprofundada à tabela periódica:
Electrões
Cascas de electrões e o modelo de Bohr
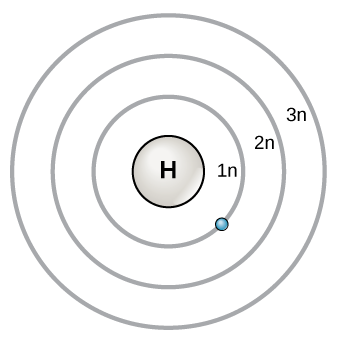
Figura 4: O modelo de Bohr.
É de salientar que existe uma relação entre o número de protões de um elemento, o número atómico que distingue um elemento de outro, e o número de electrões que possui. Em todos os átomos eletricamente neutros, o número de electrões é igual ao número de protões. Assim, cada elemento, pelo menos quando eletricamente neutro, tem um número caraterístico de electrões igual ao seunúmero atómico.
Um modelo inicial do átomo foi desenvolvido em 1913 pelo cientista dinamarquês Niels Bohr (1885-1962). Neste modelo, os electrões existem dentro de camadas principais. Um eletrão existe normalmente na camada de energia mais baixa disponível, que é a mais próxima do núcleo. A energia de um fotão de luz pode fazê-lo subir para uma camada de energia mais alta, mas esta situação é instável e o eletrão decai rapidamente paraNo processo, é libertado um fotão de luz.
O modelo de Bohr mostra o átomo como um núcleo central que contém protões e neutrões, com os electrões em forma circular orbitais Estas órbitas formam camadas de electrões ou níveis de energia, que são uma forma de visualizar o número de electrões nas camadas mais externas. Estes níveis de energia são designados por um número e o símbolo "n". Por exemplo, 1n representa o primeiro nível de energia localizado mais próximo do núcleo.
Os electrões preenchem as orbitais numa ordem consistente: primeiro preenchem as orbitais mais próximas do núcleo, depois continuam a preencher as orbitais de energia crescente mais afastadas do núcleo. Se existirem várias orbitais de igual energia, estas serão preenchidas com um eletrão em cada nível de energia antes de ser adicionado um segundo eletrão. Os electrões do nível de energia mais exterior determinam a energiaestabilidade do átomo e a sua tendência para formar ligações químicas com outros átomos para formar moléculas.
Em condições normais, os átomos preenchem primeiro as camadas internas, resultando frequentemente num número variável de electrões na camada mais externa. A camada mais interna tem um máximo de dois electrões, mas as duas camadas electrónicas seguintes podem ter, cada uma, um máximo de oito electrões. regra dos octetos que afirma, com exceção da camada mais interna, que os átomos são energeticamente mais estáveis quando têm oito electrões nas suas camadas camada de valência Exemplos de alguns átomos neutros e das suas configurações electrónicas são mostrados na Figura 5. Repare que, nesta figura, o hélio tem uma camada eletrónica externa completa, com dois electrões a preencher a sua primeira e única camada. Do mesmo modo, o néon tem uma camada externa 2n completa, contendo oito electrões. Em contraste, o cloro e o sódio têm sete e um nas suas camadas externas,respetivamente, mas teoricamente seriam mais estáveis do ponto de vista energético se seguissem a regra do octeto e tivessem oito.