Objectivos de aprendizagem
- Compreender a teoria das colisões.
- Compreender os quatro principais factores que afectam a velocidade de reação.
Cinética da reação Algumas reacções podem ocorrer a um ritmo explosivamente rápido, como a detonação de fogo de artifício (Figura 17.1 " Fogo de artifício à noite sobre o rio" ), enquanto outras podem ocorrer a um ritmo lento ao longo de muitos anos, como o enferrujamento do arame farpado exposto aos elementos (Figura 17.2 " Arame farpado enferrujadoWire" ).
Figura 17.1 Fogos de artifício à noite sobre o rio

A reação química nos fogos de artifício ocorre a uma velocidade explosiva[1].
Figura 17.2: Arame farpado enferrujado

A ferrugem do arame farpado ocorre ao longo de muitos anos[2].
Teoria da colisão
Para compreender a cinética das reacções químicas e os factores que afectam a cinética, devemos começar por examinar o que acontece durante uma reação a nível molecular. De acordo com a teoria das colisões Para que ocorra uma "colisão efectiva", as moléculas reagentes devem estar orientadas corretamente no espaço para facilitar a quebra e a formação de ligações e o rearranjo dos átomos que resultam na formação de moléculas de produto (Figura 17.3 "Visualizações de colisão").
Figura 17.3 Visualizações de colisão
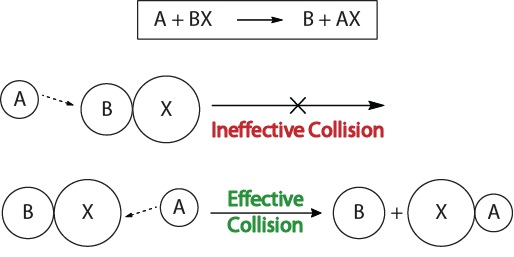
Esta visualização mostra uma colisão ineficaz e eficaz com base na orientação molecular.
Durante uma colisão molecular, as moléculas também devem possuir uma quantidade mínima de energia cinética para que ocorra uma colisão efectiva. Esta energia varia para cada reação e é conhecida como a energia de ativação ( E a ) (A velocidade da reação depende, portanto, da energia de ativação; uma energia de ativação mais elevada significa que menos moléculas terão energia suficiente para sofrer uma colisão efectiva.
Figura 17.4 Energia potencial e energia de ativação
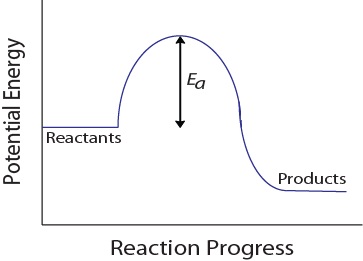
Este diagrama de energia potencial mostra a energia de ativação de uma reação hipotética.
Factores que afectam a taxa
Existem quatro factores principais que podem afetar a velocidade de reação de uma reação química:
1. Concentração do reagente. O aumento da concentração de um ou mais reagentes aumenta frequentemente a velocidade da reação, uma vez que uma concentração mais elevada de um reagente leva a um maior número de colisões desse reagente num determinado período de tempo.
2. Estado físico dos reagentes e área de superfície. Se as moléculas dos reagentes existirem em diferentes fases, como numa mistura heterogénea, a velocidade da reação será limitada pela área de superfície das fases que estão em contacto. Por exemplo, se um reagente metálico sólido e um reagente gasoso forem misturados, apenas as moléculas presentes na superfície do metal são capazes de colidir com as moléculas do gás. Por conseguinte, se a área de superfície do metal for aumentada embater-lhe ou cortá-lo em muitos pedaços aumentará a sua taxa de reação.
3. Temperatura Um aumento da temperatura aumenta tipicamente a velocidade de reação. Um aumento da temperatura aumenta a energia cinética média das moléculas reagentes. Por conseguinte, uma maior proporção de moléculas terá a energia mínima necessária para uma colisão eficaz (Figura 17.5 "Temperatura e velocidade de reação").
Figura. 17.5 Temperatura e velocidade de reação
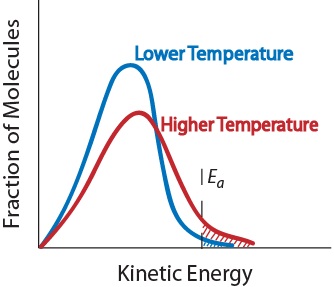
Efeito da temperatura na distribuição da energia cinética das moléculas numa amostra
4. Presença de um catalisador . A catalisador é uma substância que acelera uma reação, participando nela sem ser consumida. Os catalisadores fornecem uma via de reação alternativa para obter produtos. São fundamentais para muitas reacções bioquímicas. Serão examinados mais detalhadamente na secção "Catálise".
Principais conclusões
- As reacções ocorrem quando duas moléculas reagentes colidem efetivamente, cada uma com energia mínima e orientação correcta.
- A concentração de reagentes, o estado físico dos reagentes e a área de superfície, a temperatura e a presença de um catalisador são os quatro principais factores que afectam a velocidade de reação.
- Fogo de artifício à noite sobre o rio por Jon Sullivan/Domínio Público ↵
- Arame farpado (após anos de trabalho árduo) por Waugsberg/CC-BY-SA 3.0 ↵