Objectivos de aprendizagem
No final desta secção, será capaz de
- Calcular as massas das fórmulas de compostos covalentes e iónicos
Podemos argumentar que a ciência química moderna começou quando os cientistas começaram a explorar os aspectos quantitativos e qualitativos da química. Por exemplo, a teoria atómica de Dalton foi uma tentativa de explicar os resultados das medições que lhe permitiram calcular as massas relativas dos elementos combinados em vários compostos. Compreender a relação entre as massas dos átomos e asAs fórmulas químicas dos compostos permitem-nos descrever quantitativamente a composição das substâncias.
Fórmula Massa
Num capítulo anterior, descrevemos o desenvolvimento da unidade de massa atómica, o conceito de massas atómicas médias e a utilização de fórmulas químicas para representar a composição elementar das substâncias. Estas ideias podem ser alargadas para calcular a massa da fórmula de uma substância através da soma das massas atómicas médias de todos os átomos representados na fórmula da substância.
Fórmula de massa para substâncias covalentes
No caso das substâncias covalentes, a fórmula representa o número e os tipos de átomos que compõem uma única molécula da substância; por conseguinte, a massa da fórmula pode ser corretamente referida como massa molecular. Considere o clorofórmio (CHCl 3 A fórmula molecular do clorofórmio indica que uma única molécula contém um átomo de carbono, um átomo de hidrogénio e três átomos de cloro. A massa molecular média de uma molécula de clorofórmio é, portanto, igual à soma das massas atómicas médias destes átomosA Figura 1 descreve os cálculos utilizados para obter a massa molecular do clorofórmio, que é de 119,37 amu.
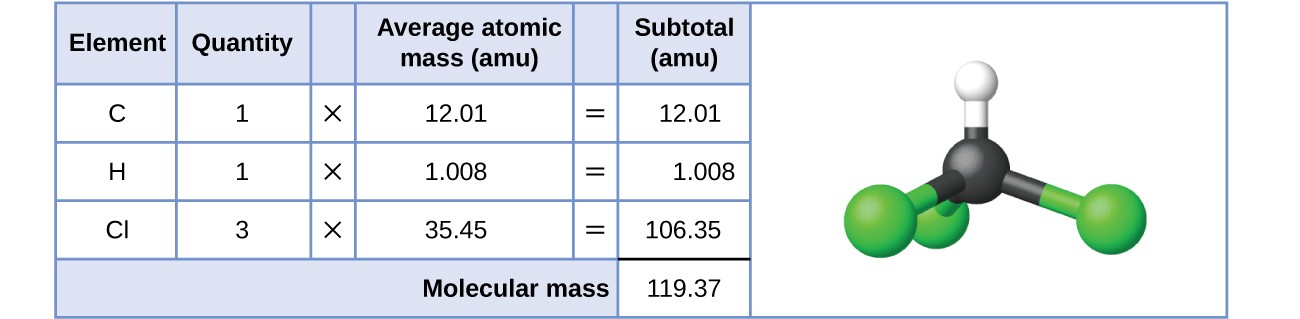
Figura 1: A massa média de uma molécula de clorofórmio, CHCl 3 O modelo mostra a estrutura molecular do clorofórmio.
Do mesmo modo, a massa molecular de uma molécula de aspirina, C 9 H 8 O 4 é a soma das massas atómicas de nove átomos de carbono, oito átomos de hidrogénio e quatro átomos de oxigénio, o que equivale a 180,15 amu (Figura 2).
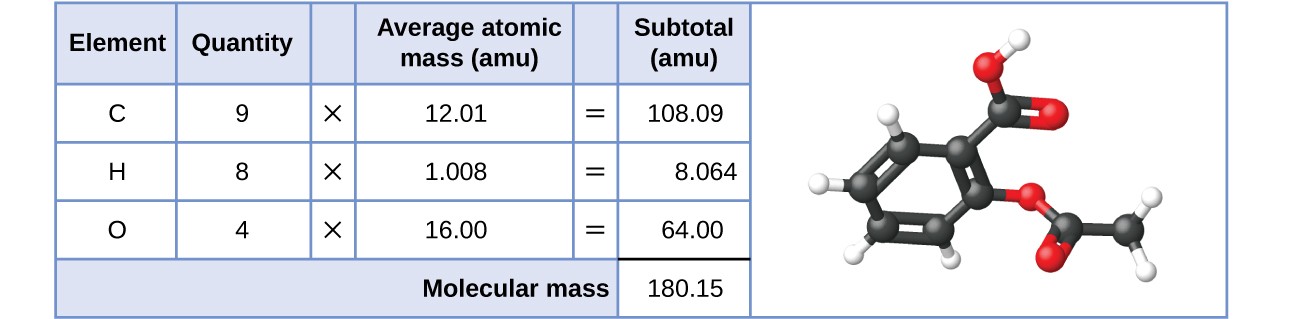
Figura 2. A massa média de uma molécula de aspirina é de 180,15 amu. O modelo mostra a estrutura molecular da aspirina, C 9 H 8 O 4 .
Exemplo 1: Cálculo da massa molecular de um composto covalente
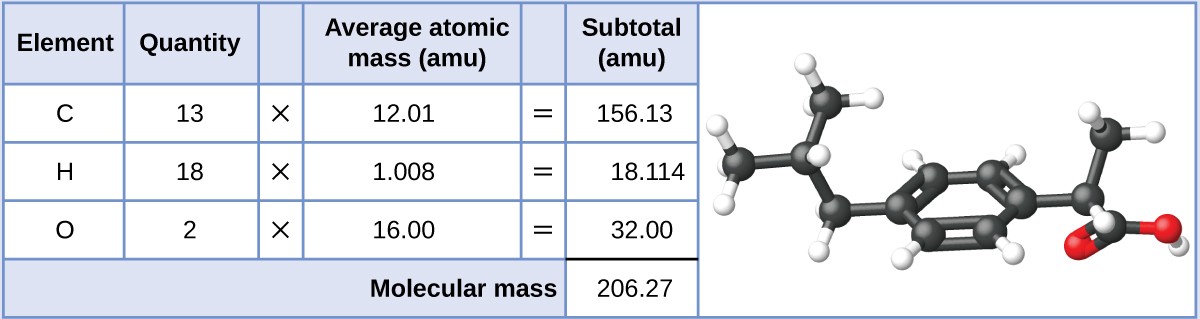
Ibuprofeno, C 13 H 18 O 2 é um composto covalente e o ingrediente ativo de vários medicamentos populares para as dores não sujeitos a receita médica, como o Advil e o Motrin. Qual é a massa molecular (amu) deste composto?
Mostrar respostaAs moléculas deste composto são constituídas por 13 átomos de carbono, 18 átomos de hidrogénio e 2 átomos de oxigénio. Seguindo a abordagem descrita acima, a massa molecular média deste composto é, portanto, de
Verificar a sua aprendizagem
Acetaminofeno, C 8 H 9 NÃO 2 O Tylenol, um composto covalente, é o ingrediente ativo de vários analgésicos populares não sujeitos a receita médica, como o Tylenol. Qual é a massa molecular (amu) deste composto?
Mostrar resposta 151.16 amuFórmula de massa para compostos iónicos
Os compostos iónicos são constituídos por catiões e aniões discretos combinados em proporções para produzir matéria eletricamente neutra. A massa da fórmula de um composto iónico é calculada da mesma forma que a massa da fórmula dos compostos covalentes: somando as massas atómicas médias de todos os átomos na fórmula do composto. No entanto, tenha em atenção que a fórmula de um composto iónico não representa acomposição de uma molécula discreta, pelo que pode não ser corretamente referida como a "massa molecular".
Como exemplo, considere o cloreto de sódio, NaCl, o nome químico do sal de mesa comum. O cloreto de sódio é um composto iónico composto por catiões de sódio, Na+, e aniões de cloreto, Cl-, combinados numa proporção de 1:1. A massa da fórmula deste composto é calculada como 58,44 amu (ver Figura 3).
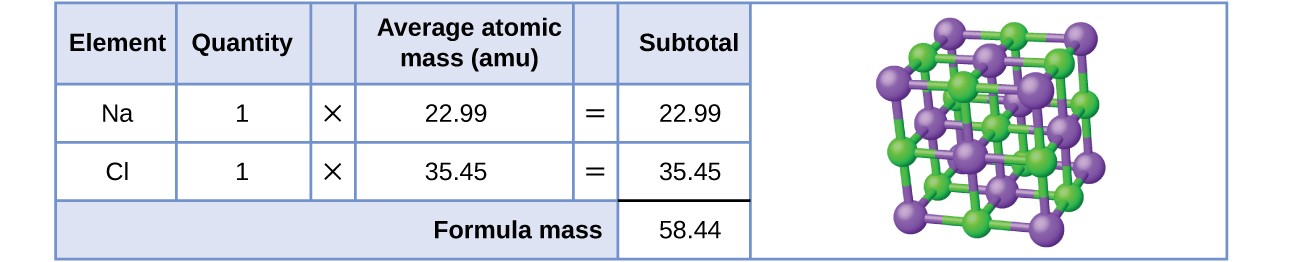
Figura 3. O sal de mesa, NaCl, contém um conjunto de iões sódio e cloreto combinados numa proporção de 1:1. A sua massa molecular é 58,44 amu.
Note-se que neste cálculo foram utilizadas as massas médias dos átomos neutros de sódio e de cloro, em vez das massas dos catiões de sódio e dos aniões de cloro. Esta abordagem é perfeitamente aceitável quando se calcula a massa da fórmula de um composto iónico. Embora um catião de sódio tenha uma massa ligeiramente inferior à de um átomo de sódio (uma vez que lhe falta um eletrão), esta diferença será compensada pelaAlém disso, a massa de um eletrão é negligenciável em relação à massa de um átomo típico. Mesmo quando se calcula a massa de um ião isolado, os electrões em falta ou adicionais podem geralmente ser ignorados, uma vez que a sua contribuição para a massa total é negligenciável, reflectindo-se apenas na massa nãoAs poucas excepções a esta regra são os iões muito leves derivados de elementos com massas atómicas conhecidas com precisão.
Exemplo 2: Cálculo da massa da fórmula de um composto iónico
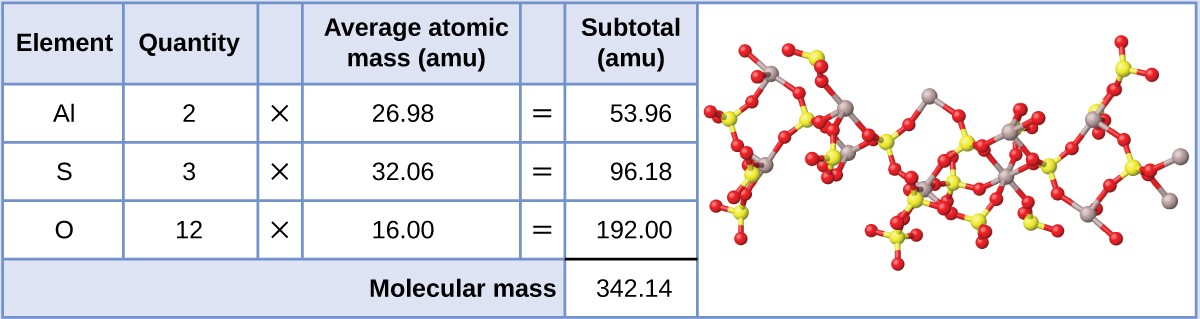
Sulfato de alumínio, Al 2 (SO 4 ) 3 O ácido sulfúrico é um composto iónico utilizado no fabrico de papel e em vários processos de purificação de água. Qual é a massa da fórmula (amu) deste composto?
Mostrar respostaA fórmula deste composto indica que contém Al3+ e SO 4 Para efeitos de cálculo da massa da fórmula, é útil reescrever a fórmula no formato mais simples, Al 2 S 3 O 12 Seguindo a abordagem acima descrita, a massa da fórmula deste composto é calculada da seguinte forma:
Verificar a sua aprendizagem
Fosfato de cálcio, Ca 3 (PO 4 ) 2 O fosfato de cálcio é um composto iónico e um agente antiaglomerante comum adicionado aos produtos alimentares. Qual é a massa da fórmula (amu) do fosfato de cálcio?
Mostrar resposta 310.18 amuConceitos-chave e resumo
A massa da fórmula de uma substância é a soma das massas atómicas médias de cada átomo representado na fórmula química e é expressa em unidades de massa atómica. A massa da fórmula de um composto covalente é também designada por massa molecular.