A: A definição de Brønsted-Lowry de acidez e basicidade
A primeira delas foi proposta em 1923 pelo químico dinamarquês Johannes Brønsted e pelo químico inglês Thomas Lowry, e ficou conhecida como a definição de ácido-base. Definição de Brønsted-Lowry de acidez e basicidade Um ácido, segundo a definição de Brønsted-Lowry, é uma espécie que actua como dador de protões (ou seja, cede um H+), enquanto uma base é um aceitador de protões (H+). Um dos exemplos mais conhecidos de uma reação ácido-base de Brønsted-Lowry é entre o ácido clorídrico e o ião hidróxido:
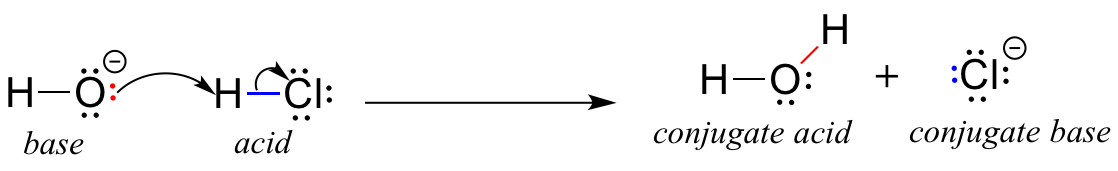
Nesta reação, um protão é transferido do HCl (o ácido, ou protão doador ) em ião hidróxido (a base, ou protão aceitador Como aprendemos no capítulo anterior, as setas curvas representam o movimento dos electrões neste processo de quebra e formação de ligações.
Depois de um ácido de Brønsted-Lowry doar um protão, o que resta é designado por base conjugada O ião cloreto é, portanto, a base conjugada do ácido clorídrico. Inversamente, quando uma base de Brønsted-Lowry aceita um protão, é convertida na sua base conjugada. ácido conjugado forma: a água é, portanto, o ácido conjugado do ião hidróxido.
Aqui está uma reação orgânica ácido-base entre o ácido acético e a metilamina:
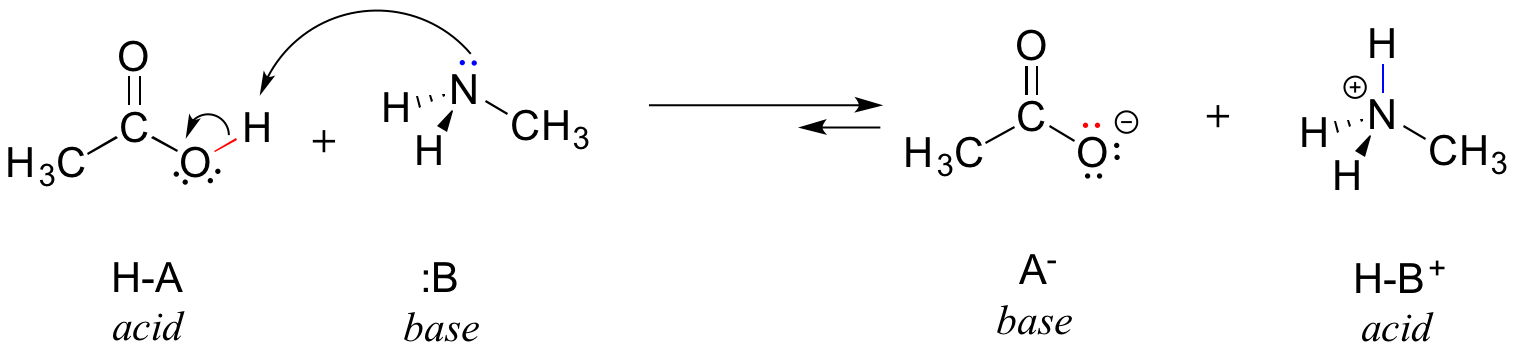
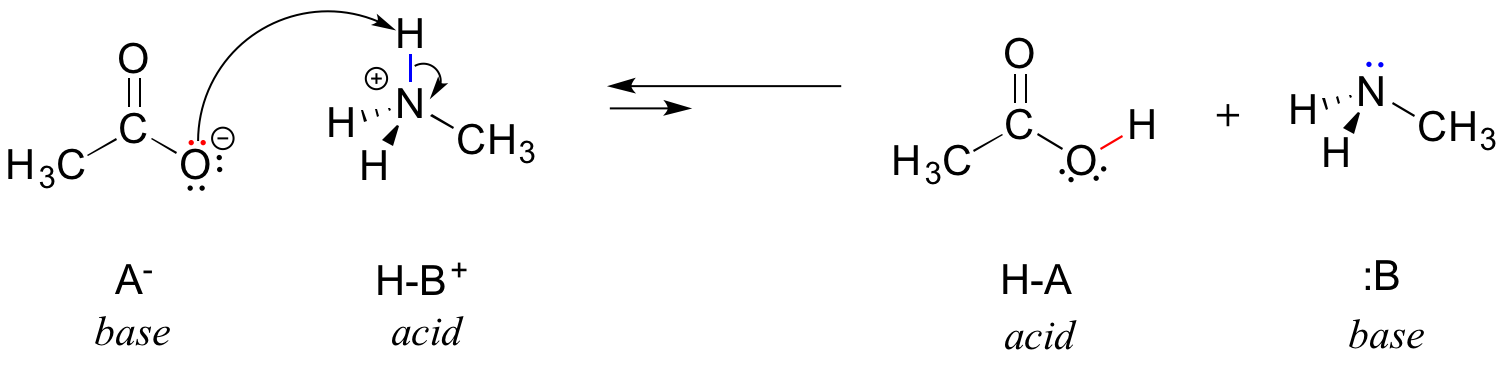
Na inversão desta reação, o ião acetato é a base e o ião metilamónio (metilamina protonada) é o ácido.
O que é que torna um composto ácido (suscetível de doar um protão) ou básico (suscetível de aceitar um protão)? Responder a esta pergunta é uma das nossas principais tarefas neste capítulo e vai exigir que utilizemos muito do que aprendemos sobre estrutura orgânica nos dois primeiros capítulos, bem como as ideias sobre termodinâmica que revimos no capítulo 5.
Para já, vamos considerar apenas uma propriedade comum das bases: para atuar como base, uma molécula deve ter um par de electrões reactivos Em todas as reacções ácido-base que veremos neste capítulo, a espécie básica tem um átomo com um par de electrões solitário. Quando a metilamina actua como uma base, por exemplo, o par de electrões solitário no átomo de azoto é utilizado para formar uma nova ligação a um protão. Uma carga negativa indica frequentemente (mas nem sempre!) que uma estrutura (neste caso, um anião) tem probabilidade de atuar como uma base.
Claramente, o ião metilamónio não pode atuar como uma base - não tem um par reativo de electrões para aceitar um protão.
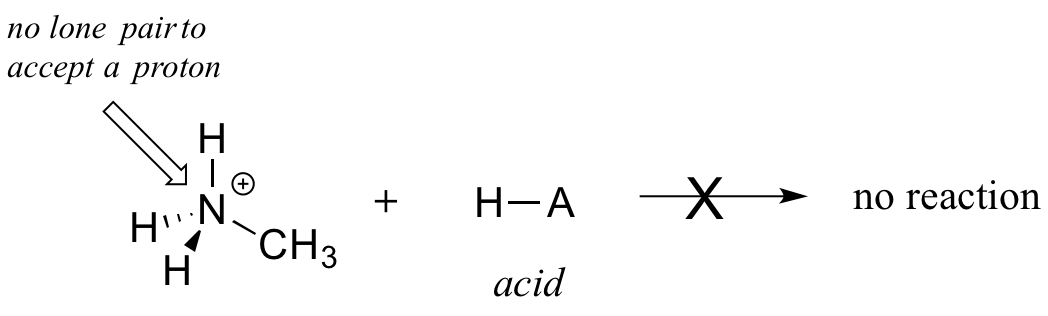
Mais tarde, no capítulo 10, estudaremos as reacções em que um par de electrões numa ligação pi de um alceno actua de forma básica - mas, por agora, concentrar-nos-emos na basicidade dos electrões sem ligação (par solitário).