Objectivos de aprendizagem
- Definir reação química .
- Utilizar uma equação química equilibrada para representar uma reação química.
Água (H 2 O) é composto por hidrogénio e oxigénio. Suponhamos que imaginamos um processo no qual tomamos algum hidrogénio elementar (H 2 ) e oxigénio elementar (O 2 ) e deixá-los reagir para formar água. O enunciado:
o hidrogénio e o oxigénio reagem para formar água
A Figura 5.1 "A Formação da Água" mostra um exemplo bastante dramático desta mesma reação.

Figura 5.1 A formação da água O hidrogénio e o oxigénio combinam-se para formar água. Aqui, o gás hidrogénio no zepelim SS Hindenburg reage com o oxigénio no ar para formar água. Fonte: Foto cortesia da Marinha dos EUA, //commons.wikimedia.org/wiki/File:Hindenburg_burning.jpg.
Para simplificar a escrita das reacções, utilizamos fórmulas em vez de nomes quando descrevemos uma reação. Também podemos utilizar símbolos para representar outras palavras na reação. Um sinal de mais liga as substâncias iniciais (e as substâncias finais, se houver mais do que uma) e uma seta (→) representa a mudança química:
H 2 + O 2 → H 2 O
Esta afirmação é um exemplo de uma equação química , uma forma abreviada de usar símbolos para representar uma mudança química. As substâncias do lado esquerdo da seta são chamadas de reagentes , e as substâncias do lado direito da seta são chamadas de produtos . Não é incomum incluir um rótulo de fase com cada fórmula - (s) para sólido, (ℓ) para líquido, (g) para gás e (aq) para uma substânciadissolvido em água, também conhecido como solução aquosa Se incluíssemos etiquetas de fase para os reagentes e produtos, em condições ambientais normais, a reação seria a seguinte
H 2 (g) + O 2 (g) → H 2 O(ℓ)
Nota
As equações químicas também podem ser utilizadas para descrever alterações físicas, o que veremos em breve.
Esta equação ainda não está completa porque não satisfaz a lei da conservação da matéria Conte o número de átomos de cada elemento em cada lado da seta. No lado do reagente, há dois átomos de H e dois átomos de O; no lado do produto, há dois átomos de H e apenas um átomo de oxigénio. A equação não está equilibrada porque o número de átomos de oxigénio em cada lado não é o mesmo (Figura 5.2 "Equilibrada - Sim ou Não?").
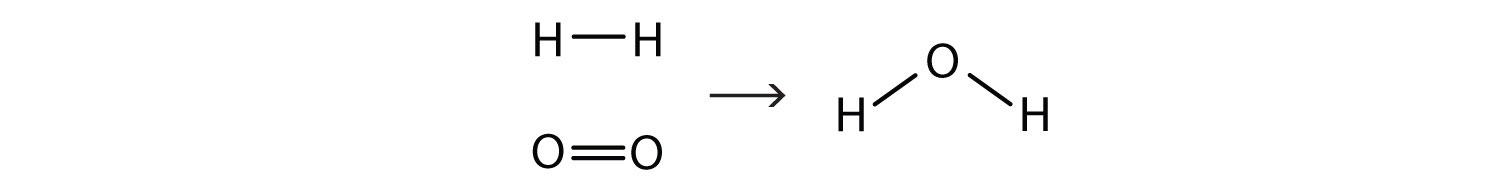
Figura 5.2 Equilibrado - Sim ou Não? Contando os átomos de cada elemento, podemos ver que a reação não está equilibrada como está escrito.
Para que esta equação química esteja de acordo com a lei da conservação da matéria, devemos rever as quantidades dos reagentes e dos produtos, conforme necessário, para obter o mesmo número de átomos de um determinado elemento em cada lado. Como cada substância tem uma fórmula química caraterística, não podemos alterar as fórmulas químicas das substâncias individuais. Por exemplo, não podemos alterar a fórmula deoxigénio elementar em O. No entanto, podemos assumir que podem estar envolvidos diferentes números de moléculas de reagentes ou de moléculas de produtos. Por exemplo, talvez sejam produzidas duas moléculas de água e não apenas uma:
H 2 (g) + O 2 (g) → 2H 2 O(ℓ)
O 2 que precede a fórmula da água chama-se coeficiente e implica a formação de duas moléculas de água. Existem agora dois átomos de oxigénio em cada lado da equação.
Nota
Este ponto é tão importante que devemos repeti-lo. não pode alterar a fórmula de uma substância química para equilibrar uma reação química! deve utilizar a fórmula química correcta da substância.
Infelizmente, ao inserirmos o coeficiente 2 à frente da fórmula da água, alterámos também o número de átomos de hidrogénio no lado do produto. Como resultado, já não temos o mesmo número de átomos de hidrogénio em cada lado. No entanto, isto pode ser facilmente resolvido colocando um coeficiente de 2 à frente do reagente hidrogénio diatómico:
2H 2 (g) + O 2 (g) → 2H 2 O(ℓ)
Agora temos quatro átomos de hidrogénio e dois átomos de oxigénio em cada lado da equação. A lei da conservação da matéria é satisfeita porque agora temos o mesmo número de átomos de cada elemento nos reagentes e nos produtos. Dizemos que a reação está equilibrada Uma propriedade de uma equação química quando existe o mesmo número de átomos de cada elemento nos reagentes e nos produtos. (Figura 5.3"O oxigénio diatómico tem um coeficiente de 1, que normalmente não é escrito, mas assumido em equações químicas equilibradas.

Figura 5.3 Equilibrado - Sim ou Não?
Contando os átomos de cada elemento, podemos ver que a reação está agora equilibrada.
Escrever reacções equilibradas é a forma de um químico reconhecer a lei da conservação da matéria.
Exemplo 1
Cada equação química está equilibrada?
- 2Na(s) + O 2 (g) → 2Na 2 O(s)
- CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O(ℓ)
- AgNO 3 (aq) + 2KCl(aq) → AgCl(s) + KNO 3 (aq)
Solução
Mostrar resposta1) Por contagem, encontramos dois átomos de sódio e dois átomos de oxigénio nos reagentes e quatro átomos de sódio e dois átomos de oxigénio nos produtos. Esta equação não está equilibrada.
Os reagentes têm um átomo de carbono, quatro átomos de hidrogénio e quatro átomos de oxigénio. Os produtos têm um átomo de carbono, quatro átomos de hidrogénio e quatro átomos de oxigénio. Esta equação está equilibrada.
3) Os reagentes têm um átomo de prata, um átomo de azoto, três átomos de oxigénio, dois átomos de potássio e dois átomos de cloro. Os produtos têm um átomo de prata, um átomo de cloro, um átomo de potássio, um átomo de azoto e três átomos de oxigénio.