Objectivos de aprendizagem
- Determinar a fórmula química de um composto covalente simples a partir do seu nome.
- Determinar o nome de um composto covalente simples a partir da sua fórmula química.
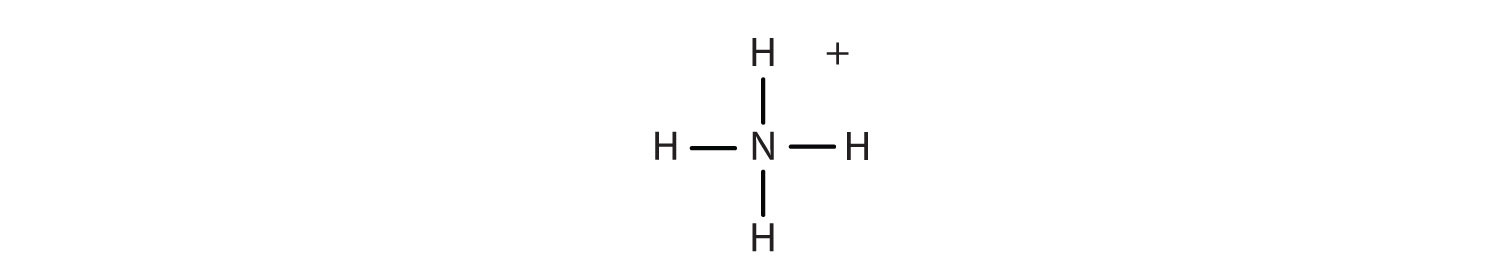
Que elementos formam ligações covalentes? As ligações covalentes formam-se quando dois ou mais não-metais se combinam. Por exemplo, o hidrogénio e o oxigénio são não-metais e, quando se combinam para formar água, fazem-no através da formação de ligações covalentes. Os átomos não-metálicos em iões poliatómicos estão unidos por ligações covalentes, mas o ião como um todo participa em ligações iónicas. Por exemplo, o cloreto de amónio tem ligações iónicas entre umião poliatómico, NH 4 +, e Cl-, mas no ião amónio, os átomos de azoto e de hidrogénio estão ligados por ligações covalentes:
Exemplo 2
Cada composto é formado por ligações iónicas, ligações covalentes ou ambas?
- Na 2 O
- Na 3 PO 4
- N 2 O 4
Solução
Mostrar resposta- Os elementos do Na2O são um metal e um não metal, que formam ligações iónicas.
- Como o sódio é um metal e reconhecemos a fórmula do ião fosfato (ver Tabela 3.1 "Alguns iões poliatómicos"), sabemos que este composto é iónico. No entanto, os iões poliatómicos são mantidos juntos por ligações covalentes, pelo que este composto contém ligações iónicas e covalentes.
- Os elementos do N2O4 são ambos não-metais, em vez de um metal e um não-metal. Por isso, os átomos formam ligações covalentes.