Resultados da aprendizagem
- Enunciar a lei periódica e explicar a organização dos elementos na tabela periódica
- Prever as propriedades gerais dos elementos com base na sua localização na tabela periódica
- Identificar metais, não metais e metaloides pelas suas propriedades e/ou localização na tabela periódica
À medida que os primeiros químicos trabalhavam na purificação de minérios e descobriam mais elementos, aperceberam-se de que vários elementos podiam ser agrupados pelos seus comportamentos químicos semelhantes. Um desses agrupamentos inclui o lítio (Li), o sódio (Na) e o potássio (K): todos estes elementos são brilhantes, conduzem bem o calor e a eletricidade e têm propriedades químicas semelhantes. Um segundo agrupamento inclui o cálcio (Ca), o estrôncio(Sr) e bário (Ba), que também são brilhantes, bons condutores de calor e eletricidade e têm propriedades químicas em comum. No entanto, as propriedades específicas destes dois grupos são notavelmente diferentes entre si. Por exemplo: Li, Na e K são muito mais reactivos do que Ca, Sr e Ba; Li, Na e K formam compostos com oxigénio numa proporção de dois dos seus átomos para um átomo de oxigénio, enquantoO flúor (F), o cloro (Cl), o bromo (Br) e o iodo (I) também apresentam propriedades semelhantes entre si, mas estas propriedades são drasticamente diferentes das de qualquer um dos elementos acima referidos.
Dimitri Mendeleev na Rússia (1869) e Lothar Meyer na Alemanha (1870) reconheceram independentemente que existia uma relação periódica entre as propriedades dos elementos conhecidos na altura. Ambos publicaram tabelas com os elementos dispostos de acordo com o aumento da massa atómica. Mas Mendeleev foi mais longe do que Meyer: utilizou a sua tabela para prever a existência de elementos que teriam propriedades semelhantes às do alumínio e do silício, masAs descobertas do gálio (1875) e do germânio (1886) deram um grande apoio ao trabalho de Mendeleev. Embora Mendeleev e Meyer tenham tido uma longa disputa sobre a prioridade, as contribuições de Mendeleev para o desenvolvimento da tabela periódica são agora mais amplamente reconhecidas (Figura 1).
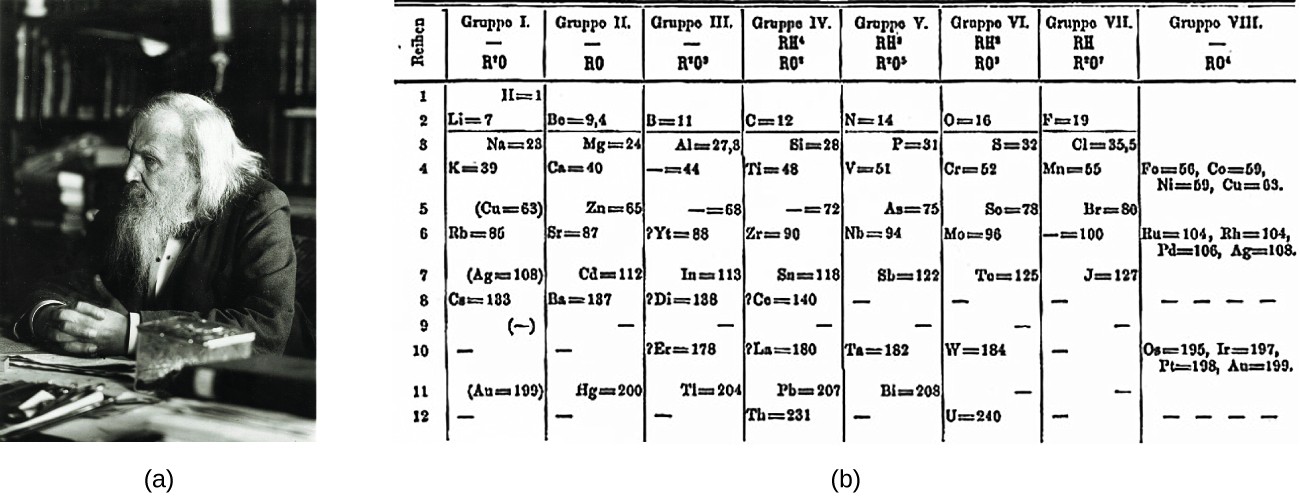
Figura 1: (a) Atribui-se a Dimitri Mendeleev a criação (b) da primeira tabela periódica dos elementos (crédito a: modificação da obra de Serge Lachinov; crédito b: modificação da obra de "Den fjättrade ankan"/Wikimedia Commons)
Pode ver a transcrição de "The Periodic Table: Crash Course Chemistry #4" aqui (abre numa nova janela).
No século XX, tornou-se evidente que a relação periódica envolvia números atómicos em vez de massas atómicas. A declaração moderna desta relação, a lei periódica é a seguinte: as propriedades dos elementos são funções periódicas dos seus números atómicos Moderno tabela periódica organiza os elementos por ordem crescente do seu número atómico e agrupa átomos com propriedades semelhantes na mesma coluna vertical (Figura 2). Cada caixa representa um elemento e contém o seu número atómico, símbolo, massa atómica média e (por vezes) nome. Os elementos estão dispostos em sete filas horizontais, designadas por períodos ou série e 18 colunas verticais, denominadas grupos Os grupos são rotulados no topo de cada coluna. Nos Estados Unidos, os rótulos são tradicionalmente números romanos com letras maiúsculas. No entanto, a IUPAC recomenda que sejam usados os números de 1 a 18, e estes rótulos são mais comuns. Para que a tabela caiba numa única página, partes de duas das linhas, num total de 14 colunas, são geralmente escritas abaixo do corpo principal da tabela.
Figura 2. Os elementos da tabela periódica estão organizados de acordo com as suas propriedades.
Muitos elementos diferem drasticamente nas suas propriedades químicas e físicas, mas alguns elementos são semelhantes nos seus comportamentos. Por exemplo, muitos elementos têm um aspeto brilhante, são maleáveis (podem ser deformados sem se partirem) e dúcteis (podem ser estirados em fios), e conduzem bem o calor e a eletricidade. Outros elementos não são brilhantes, maleáveis ou dúcteis, e são maus condutores de calor e eletricidade.Podemos ordenar os elementos em grandes classes com propriedades comuns: metais (elementos brilhantes, maleáveis, bons condutores de calor e eletricidade - a amarelo); não-metais (elementos que parecem baços, maus condutores de calor e eletricidade - sombreados a verde); e metalóides (elementos que conduzem moderadamente bem o calor e a eletricidade e possuem algumas propriedades dos metais e algumas propriedades dos não-metais - a roxo).
Os elementos também podem ser classificados em elementos do grupo principal (ou elementos representativos ) nas colunas designadas por 1, 2 e 13-18; o metais de transição nas colunas 3-12; e metais de transição interna nas duas linhas da parte inferior da tabela (os elementos da linha superior são designados por lantanídeos e os elementos da linha inferior são actinídeos Os elementos podem ainda ser subdivididos por propriedades mais específicas, como a composição dos compostos que formam. Por exemplo, os elementos do grupo 1 (a primeira coluna) formam compostos constituídos por um átomo do elemento e um átomo de hidrogénio. Estes elementos (exceto o hidrogénio) são conhecidos como metais alcalinos Os elementos do grupo 2 (a segunda coluna) formam compostos constituídos por um átomo do elemento e dois átomos de hidrogénio: são os chamados metais alcalino-terrosos Outros grupos com nomes específicos são os grupos pnictogénicos (grupo 15), calcogénios (grupo 16), halogéneos (grupo 17), e o gases nobres (grupo 18, também conhecido por gases inertes Os grupos também podem ser designados pelo primeiro elemento do grupo: por exemplo, os calcogénios podem ser designados por grupo do oxigénio ou família do oxigénio. O hidrogénio é um elemento único, não metálico, com propriedades semelhantes às dos elementos do grupo 1 e do grupo 17. Por essa razão, o hidrogénio pode ser apresentado no topo de ambos os grupos ou isoladamente.
Figura 3 - A tabela periódica organiza os elementos com propriedades semelhantes em grupos.
Clique nesta hiperligação para a Royal Society of Chemistry para obter uma tabela periódica interactiva, que pode utilizar para explorar as propriedades dos elementos (inclui podcasts e vídeos de cada elemento). Também pode experimentar esta tabela do site PeriodicTable.com que mostra fotografias de todos os elementos.Exemplo 1: Nomeação de grupos de elementos
Os átomos de cada um dos seguintes elementos são essenciais para a vida. Indique o nome do grupo dos seguintes elementos:
- cloro
- cálcio
- sódio
- enxofre
- halogéneo
- metal alcalinoterroso
- metal alcalino
- calcogénio
Verificar a sua aprendizagem
Indicar o nome do grupo para cada um dos elementos seguintes:
- crípton
- selénio
- bário
- lítio
- gás nobre
- calcogénio
- metal alcalinoterroso
- metal alcalino
O elemento 43 (tecnécio), o elemento 61 (promécio) e a maioria dos elementos com número atómico 84 (polónio) e superior têm a sua massa atómica indicada entre parêntesis rectos. Isto é feito para os elementos que consistem inteiramente em isótopos instáveis e radioactivos (aprenderá mais sobreNão é possível determinar um peso atómico médio para estes elementos porque os seus radioisótopos podem variar significativamente em abundância relativa, dependendo da fonte, ou podem nem sequer existir na natureza. O número entre parênteses rectos é o número de massa atómica (e a massa atómica aproximada) do isótopo mais estável desse elemento.
Conceitos-chave e resumo
A descoberta da recorrência periódica de propriedades semelhantes entre os elementos levou à formulação da tabela periódica, na qual os elementos estão dispostos por ordem crescente de número atómico em linhas conhecidas como períodos e colunas conhecidas como grupos. Os elementos do mesmo grupo da tabela periódica têm propriedades químicas semelhantes. Os elementos podem ser classificados como metais, metalóides eOs grupos são numerados de 1 a 18, da esquerda para a direita. Os elementos do grupo 1 são conhecidos como metais alcalinos; os do grupo 2 são os metais alcalino-terrosos; os do grupo 15 são os pnictogénios; os do grupo 16 são os calcogénios; os do grupo 17 são os halogénios; e os do grupo 18 são os gases nobres.