Objectivos de aprendizagem
- Descrever os componentes da membrana que estabelecem o potencial de membrana em repouso
- Descrever as alterações que ocorrem na membrana que resultam no potencial de ação
As funções do sistema nervoso - sensação, integração e resposta - dependem das funções dos neurónios subjacentes a estas vias. Para compreender como os neurónios são capazes de comunicar, é necessário descrever o papel de um membrana excitável A base desta comunicação é o potencial de ação, que demonstra como as alterações na membrana podem constituir um sinal. Analisar a forma como estes sinais funcionam em circunstâncias mais variáveis envolve uma análise dos potenciais graduais, que serão abordados na secção seguinte.
Membranas celulares eletricamente activas
A maioria das células do corpo utiliza partículas carregadas, iões, para acumular uma carga através da membrana celular. Anteriormente, foi demonstrado que isto faz parte do funcionamento das células musculares. Para que os músculos esqueléticos se contraiam, com base no acoplamento excitação-contração, é necessário o contributo de um neurónio. Ambas as células utilizam a membrana celular para regular o movimento dos iões entre o fluido extracelular e o citosol.
Como aprendeste no capítulo sobre as células, a membrana celular é a principal responsável pela regulação do que pode atravessar a membrana e do que fica apenas de um lado. A membrana celular é uma bicamada fosfolipídica, pelo que apenas as substâncias que podem passar diretamente através do núcleo hidrofóbico podem difundir-se sem ajuda. As partículas carregadas, que são hidrofílicas por definição, não podem atravessar a membrana celularSão necessários vários canais, bem como "bombas de iões" especializadas dependentes de energia, para gerar um potencial transmembranar e para gerar um potencial de ação. De especial interesse é a proteína transportadora referida como a bomba de sódio/potássio que move iões de sódio (Na+) para fora de uma célula eiões de potássio (K+) numa célula, regulando assim a concentração de iões em ambos os lados da membrana celular.
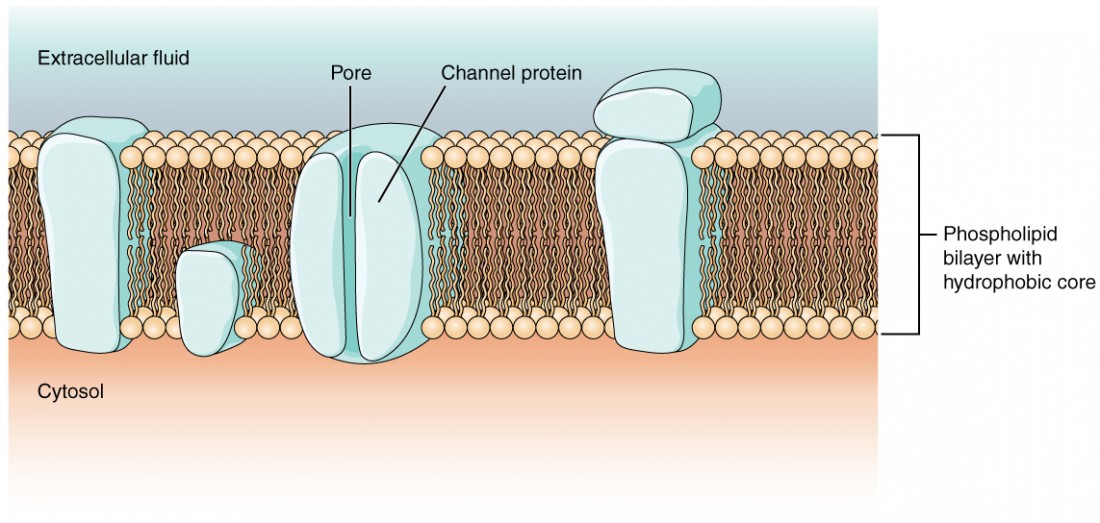
Figura 1: Membrana celular e proteínas transmembranares A membrana celular é composta por uma bicamada de fosfolípidos e tem muitas proteínas transmembranares, incluindo diferentes tipos de proteínas de canal que funcionam como canais iónicos.
A bomba de sódio/potássio necessita de energia sob a forma de trifosfato de adenosina (ATP), pelo que também é designada por ATPase. Como foi explicado no capítulo sobre as células, a concentração de Na+ é mais elevada no exterior da célula do que no interior e a concentração de K+ é mais elevada no interior da célula do que no exterior, o que significa que esta bomba move os iões contra os gradientes de concentração de sódioDe facto, a bomba mantém basicamente esses gradientes de concentração.
Os canais iónicos são poros que permitem que partículas carregadas específicas atravessem a membrana em resposta a um gradiente de concentração existente. As proteínas são capazes de atravessar a membrana celular, incluindo o seu núcleo hidrofóbico, e podem interagir com a carga dos iões devido às propriedades variadas dos aminoácidos que se encontram em domínios ou regiões específicas do canal proteico. Os aminoácidos hidrofóbicos sãoOs aminoácidos hidrofílicos estão expostos aos ambientes fluidos do fluido extracelular e do citosol. Além disso, os iões interagem com os aminoácidos hidrofílicos, que serão selectivos para a carga do ião. Os canais para catiões (iões positivos) terão cadeias laterais carregadas negativamente no poro.Os canais para aniões (iões negativos) terão cadeias laterais carregadas positivamente no poro, o que se designa por exclusão eletroquímica o que significa que o poro do canal é específico da carga.
Os iões também podem ser especificados pelo diâmetro do poro. A distância entre os aminoácidos será específica para o diâmetro do ião quando este se dissociar das moléculas de água que o rodeiam. Devido às moléculas de água que o rodeiam, os poros maiores não são ideais para iões mais pequenos, porque as moléculas de água irão interagir, por ligações de hidrogénio, mais rapidamente do que as cadeias laterais de aminoácidos.é chamado exclusão de tamanho Alguns canais iónicos são selectivos para a carga, mas não necessariamente para o tamanho, pelo que são designados por canal inespecífico Estes canais não específicos permitem que os catiões - particularmente Na+, K+ e Ca2+ - atravessem a membrana, mas excluem os aniões.
Os canais iónicos nem sempre permitem que os iões se difundam livremente através da membrana. São abertos por determinados eventos, o que significa que os canais são fechado Embora estas classes de canais iónicos se encontrem principalmente em células do tecido nervoso ou muscular, também podem ser encontradas em células de tecidos epiteliais e conjuntivos.
A canal controlado por ligandos Este tipo de canal também é conhecido como canal de sinalização, ou seja, um ligando, que se liga à região extracelular do canal. recetor ionotrópico porque quando o ligante, conhecido como neurotransmissor no sistema nervoso, se liga à proteína, os iões atravessam a membrana alterando a sua carga (Figura 2).
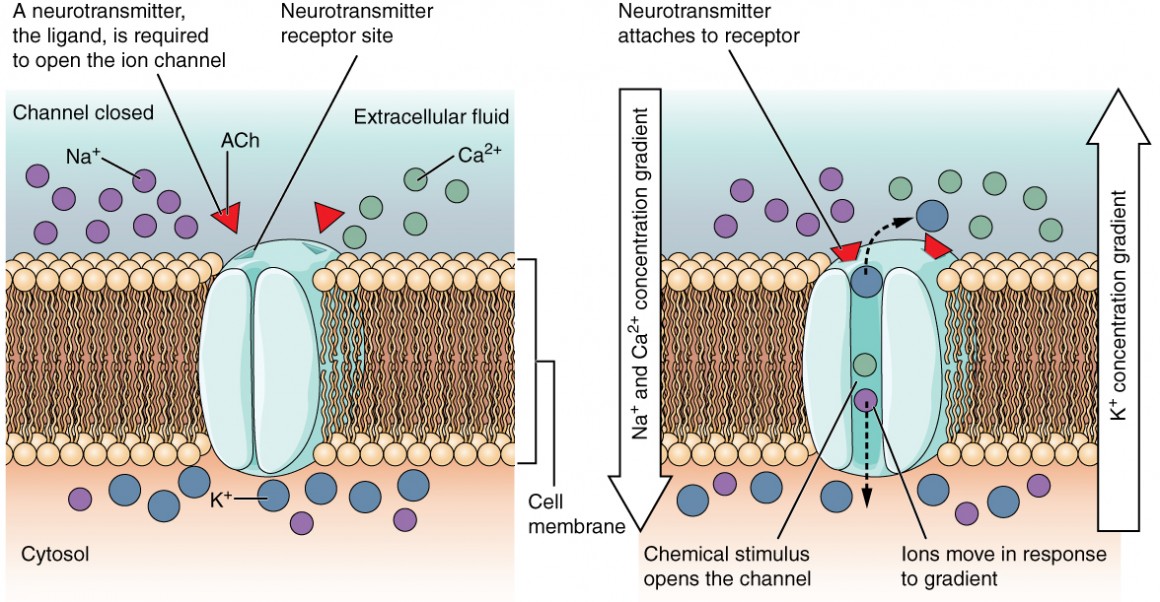
Figura 2: Canais com ligação a ligandos Quando o ligando, neste caso o neurotransmissor acetilcolina, se liga a uma localização específica na superfície extracelular da proteína do canal, o poro abre-se para permitir a passagem de iões seleccionados. Os iões, neste caso, são catiões de sódio, cálcio e potássio.
A canal mecanicamente fechado Muitos canais associados ao sentido do tato (somatossensação) são activados mecanicamente. Por exemplo, quando se aplica pressão à pele, estes canais abrem-se e permitem a entrada de iões na célula. Semelhante a este tipo de canal seria o canal que se abre com base nas alterações de temperatura, como no teste da água do duche(Figura 3).
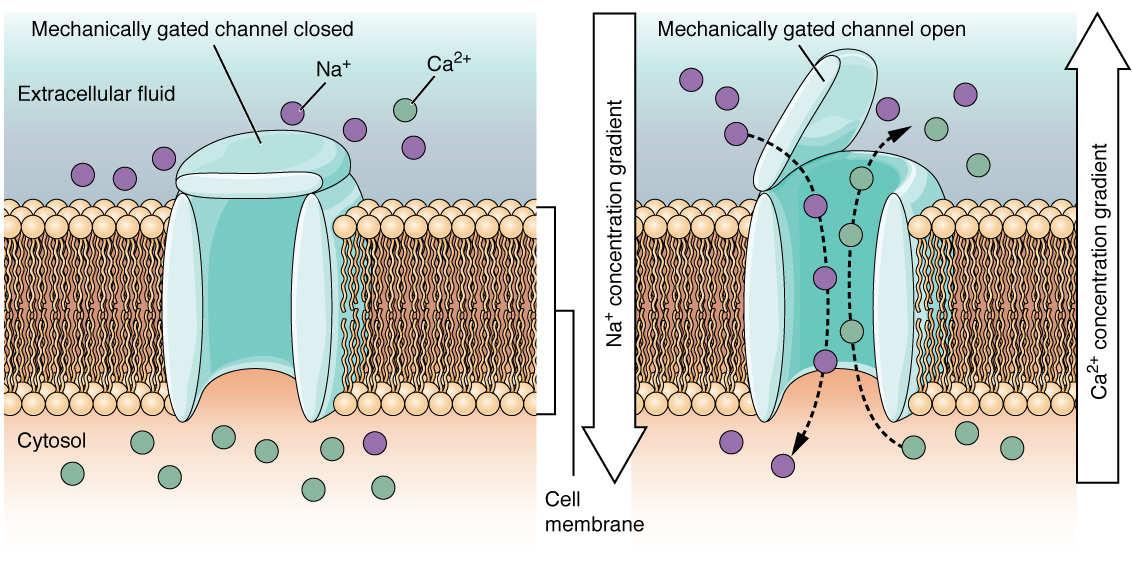
Figura 3: Canais mecanicamente fechados Quando ocorre uma alteração mecânica no tecido circundante, como pressão ou toque, o canal é fisicamente aberto. Os termorreceptores funcionam segundo um princípio semelhante. Quando a temperatura local do tecido muda, a proteína reage abrindo fisicamente o canal.
A canal controlado por voltagem É um canal que responde a alterações nas propriedades eléctricas da membrana em que se insere. Normalmente, a parte interna da membrana está sob uma tensão negativa. Quando essa tensão se torna menos negativa, o canal começa a permitir que os iões atravessem a membrana (Figura 4).
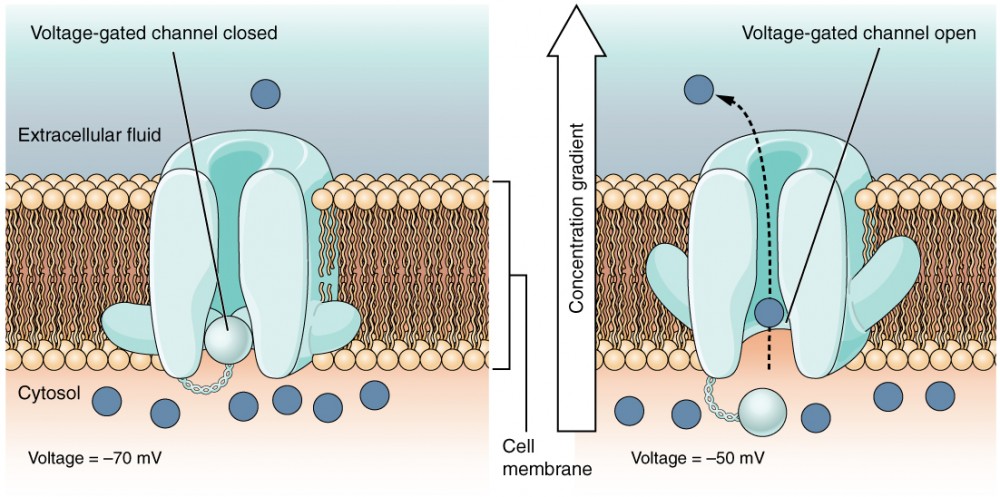
Figura 4: Canais dependentes de tensão Os canais dependentes de tensão abrem-se quando a tensão transmembranar se altera à sua volta. Os aminoácidos na estrutura da proteína são sensíveis à carga e fazem com que o poro se abra para o ião selecionado.
A canal de fuga Não existe um evento real que abra o canal; em vez disso, tem uma taxa intrínseca de comutação entre os estados aberto e fechado. Os canais de fuga contribuem para a tensão transmembranar em repouso da membrana excitável (Figura 5).
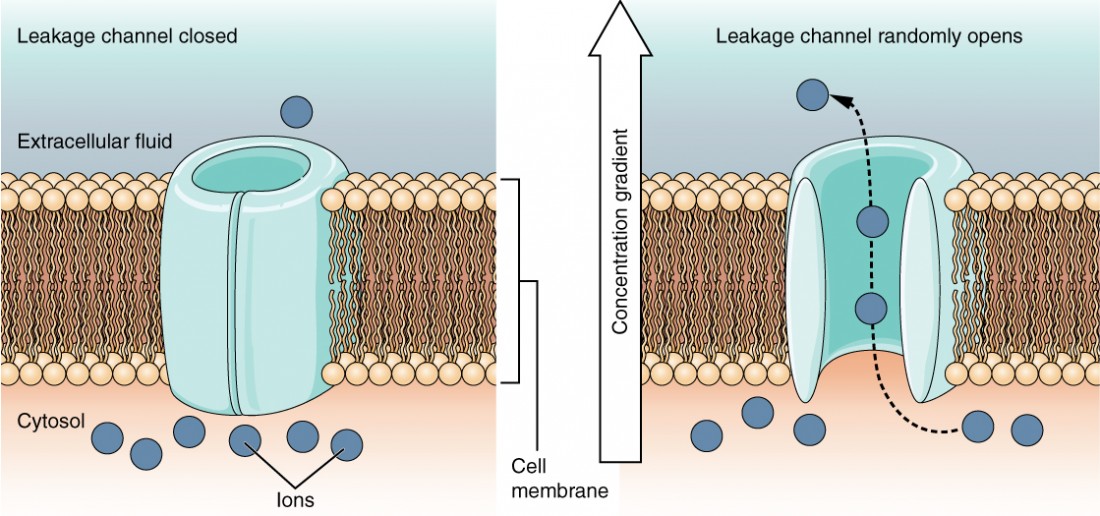
Figura 5: Canais de fuga Em determinadas situações, os iões têm de atravessar a membrana de forma aleatória. As propriedades eléctricas específicas de certas células são modificadas pela presença deste tipo de canal.
O Potencial de Membrana
O estado elétrico da membrana celular pode ter diversas variações. Todas elas são variações na potencial de membrana O potencial é uma distribuição de carga através da membrana celular, medida em milivolts (mV). A norma é comparar o interior da célula em relação ao exterior, pelo que o potencial de membrana é um valor que representa a carga no lado intracelular da membrana, com base no facto de o exterior ser zero, relativamente falando (Figura 6).
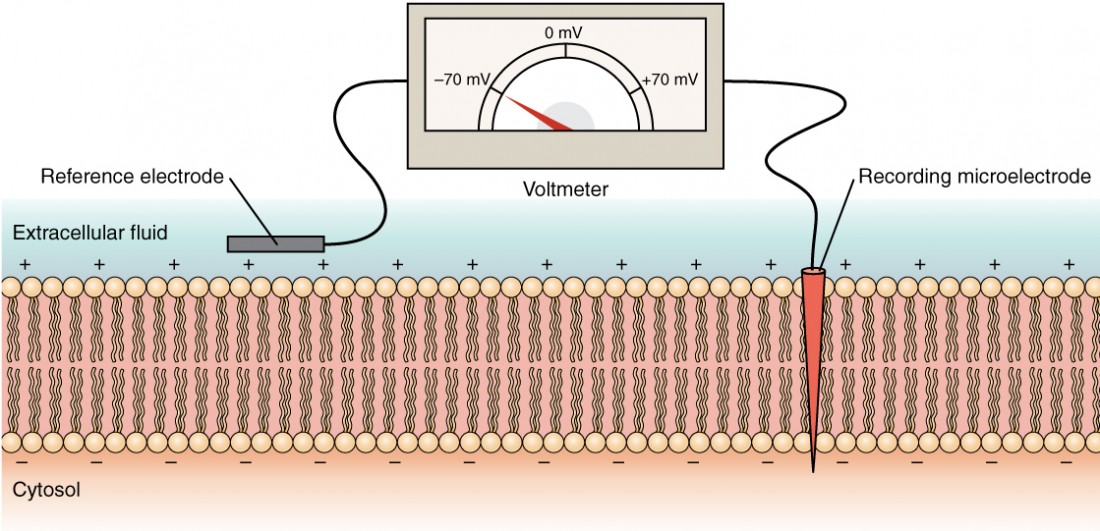
Figura 6. Medição da carga através de uma membrana com um voltímetro Um elétrodo de registo é introduzido na célula e um elétrodo de referência encontra-se no exterior da célula. Comparando a carga medida por estes dois eléctrodos, determina-se a tensão transmembranar. É convencional exprimir este valor para o citosol em relação ao exterior.
A concentração de iões nos fluidos extracelulares e intracelulares é largamente equilibrada, com uma carga líquida neutra. No entanto, ocorre uma ligeira diferença de carga na superfície da membrana, tanto interna como externamente. É a diferença nesta região muito limitada que tem todo o poder nos neurónios (e células musculares) para gerar sinais eléctricos, incluindo potenciais de ação.
Antes de se poderem descrever estes sinais eléctricos, é necessário explicar o estado de repouso da membrana. Quando a célula está em repouso e os canais iónicos estão fechados (exceto os canais de fuga que se abrem aleatoriamente), os iões distribuem-se pela membrana de uma forma muito previsível. A concentração de Na+ no exterior da célula é 10 vezes superior à concentração no interior. Além disso, a concentração deO citosol contém uma elevada concentração de aniões, sob a forma de iões fosfato e proteínas com carga negativa. Os aniões de grandes dimensões são um componente da membrana celular interna, incluindo fosfolípidos especializados e proteínas associadas ao folheto interno da membrana (folheto é um termo utilizado para um dos lados da membrana da bicamada lipídica). Os aniões negativosA carga está localizada nos grandes aniões.
Com os iões distribuídos através da membrana nestas concentrações, a diferença de carga é medida a -70 mV, o valor descrito como o potencial de membrana em repouso O valor exato medido para o potencial de membrana em repouso varia entre células, mas -70 mV é o valor mais comummente utilizado. Esta voltagem seria, na realidade, muito mais baixa se não fossem as contribuições de algumas proteínas importantes na membrana. Os canais de fuga permitem que o Na+ entre lentamente na célula ou que o K+ saia lentamente, e a bomba Na+/K+ restaura-os. Isto pode parecer um desperdício demas cada um tem um papel na manutenção do potencial de membrana.
O potencial de ação
O potencial de membrana em repouso descreve o estado estacionário da célula, que é um processo dinâmico equilibrado pela fuga de iões e pelo bombeamento de iões. Sem qualquer influência externa, não se altera. Para iniciar um sinal elétrico, o potencial de membrana tem de se alterar.
Isto começa com a abertura de um canal para o Na+ na membrana. Uma vez que a concentração de Na+ é mais elevada no exterior do que no interior da célula, por um fator de 10, os iões entram na célula, impulsionados em grande parte pelo gradiente de concentração. Uma vez que o sódio é um ião com carga positiva, altera a tensão relativa imediatamente no interior da célula em relação ao exterior. A tensão de repousoé o estado da membrana a uma voltagem de -70 mV, pelo que o catião sódio que entra na célula fará com que esta se torne menos negativa. Isto é conhecido como despolarização ou seja, o potencial de membrana move-se em direção a zero.
O gradiente de concentração do Na+ é tão forte que este continuará a entrar na célula mesmo depois de o potencial de membrana se ter tornado zero, pelo que a tensão imediatamente à volta do poro começa a tornar-se positiva. O gradiente elétrico também desempenha um papel importante, uma vez que as proteínas negativas abaixo da membrana atraem o ião sódio. O potencial de membrana atingirá +30 mV quando o sódio tiver entrado na célula.célula.
À medida que o potencial de membrana atinge +30 mV, outros canais dependentes de voltagem abrem-se na membrana. Estes canais são específicos para o ião potássio. Um gradiente de concentração actua também sobre o K+. À medida que o K+ começa a sair da célula, levando consigo uma carga positiva, o potencial de membrana começa a mover-se de volta para a sua voltagem de repouso. repolarização o que significa que a tensão da membrana volta a aproximar-se do valor de -70 mV do potencial de membrana em repouso.
A repolarização faz regressar o potencial da membrana ao valor de -70 mV que indica o potencial de repouso, mas na realidade ultrapassa esse valor. Os iões de potássio atingem o equilíbrio quando a tensão da membrana é inferior a -70 mV, pelo que ocorre um período de hiperpolarização enquanto os canais de K+ estão abertos.
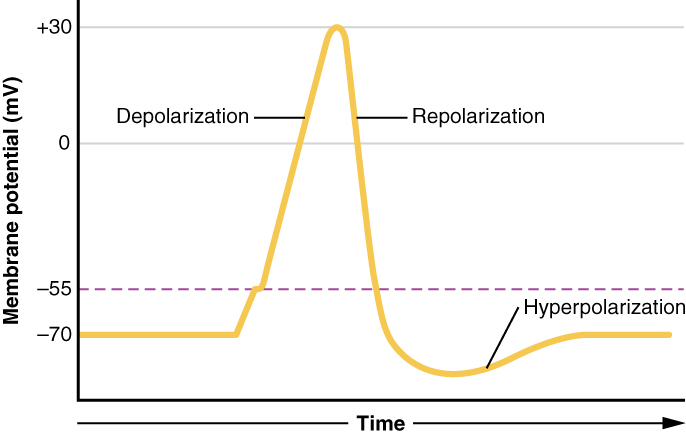
Figura 7: Gráfico do potencial de ação Traçando a tensão medida através da membrana celular em função do tempo, o potencial de ação começa com uma despolarização, seguida de uma repolarização, que passa do potencial de repouso para a hiperpolarização e, finalmente, a membrana regressa ao repouso.
O que foi descrito aqui é o potencial de ação, que é apresentado como um gráfico de voltagem ao longo do tempo na Figura 7. É o sinal elétrico que o tecido nervoso gera para a comunicação. A mudança na voltagem da membrana de -70 mV em repouso para +30 mV no final da despolarização é uma mudança de 100 mV. Isto também pode ser escrito como uma mudança de 0,1 V.
Para colocar este valor em perspetiva, pense numa pilha. Uma pilha AA, que pode encontrar num comando de televisão, tem uma tensão de 1,5 V, ou uma pilha de 9 V (a pilha retangular com dois pinos numa das extremidades) tem, obviamente, 9 V. A alteração observada no potencial de ação é uma ou duas ordens de grandeza inferior à carga nestas pilhas. De facto, o potencial de membrana pode ser descrito como umUma pilha no seu telecomando tem uma carga armazenada que é "libertada" quando prime um botão.
O que acontece através da membrana de uma célula eletricamente ativa é um processo dinâmico que é difícil de visualizar com imagens estáticas ou através de descrições de texto. Veja esta animação para saber mais sobre este processo.
Qual é a diferença entre a força motriz do Na+ e do K+? E o que é semelhante no movimento destes dois iões?
A questão é, agora, o que é que inicia o potencial de ação? A descrição acima convenientemente passa ao lado desse ponto. Mas é vital para compreender o que está a acontecer. O potencial de membrana permanecerá na voltagem de repouso até que algo mude. A descrição acima apenas diz que um canal de Na+ se abre. Agora, dizer "um canal abre-se" não significa que uma proteína transmembranar individualExistem alguns tipos diferentes de canais que permitem que o Na+ atravesse a membrana. Um canal de Na+ ligado a um ligando abre-se quando um neurotransmissor se liga a ele e um canal de Na+ ligado mecanicamente abre-se quando um estímulo físico afecta um recetor sensorial (como a pressão aplicada à pele comprime um recetor de toque). Quer seja umum neurotransmissor que se liga à sua proteína recetora ou um estímulo sensorial que ativa uma célula recetora sensorial, um estímulo qualquer dá início ao processo. O sódio começa a entrar na célula e a membrana torna-se menos negativa.
Um terceiro tipo de canal, que é uma parte importante da despolarização no potencial de ação, é o canal de Na+ controlado por voltagem. Os canais que começam a despolarizar a membrana devido a um estímulo ajudam a célula a despolarizar-se de -70 mV para -55 mV. Assim que a membrana atinge essa voltagem, os canais de Na+ controlados por voltagem abrem-se. Isto é o que se chama o limiar. Qualquer despolarização que nãoQualquer estímulo que altere o potencial de membrana para -55 mV ou mais não atingirá o limiar e, portanto, não resultará num potencial de ação. Além disso, qualquer estímulo que despolarize a membrana para -55 mV ou mais fará com que um grande número de canais se abra e se inicie um potencial de ação.
Devido ao limiar, o potencial de ação pode ser comparado a um evento digital - ou acontece ou não acontece. Se o limiar não for atingido, não ocorre qualquer potencial de ação. Se a despolarização atingir -55 mV, o potencial de ação continua e vai até +30 mV, altura em que o K+ provoca a repolarização, incluindo o overshoot hiperpolarizante.Um estímulo mais forte, que pode despolarizar a membrana muito para além do limiar, não produzirá um potencial de ação "maior". Os potenciais de ação são "tudo ou nada". Ou a membrana atinge o limiar e tudo ocorre como descrito acima, ou a membrana não atinge o limiar e nadaTodos os potenciais de ação atingem o pico com a mesma voltagem (+30 mV), pelo que um potencial de ação não é maior do que outro. Estímulos mais fortes iniciam potenciais de ação múltiplos mais rapidamente, mas os sinais individuais não são maiores. Assim, por exemplo, não sentirá uma maior sensação de dor, ou terá uma contração muscular mais forte, devido ao tamanho do potencial de ação, porquenão são de tamanhos diferentes.
Como já vimos, a despolarização e a repolarização de um potencial de ação dependem de dois tipos de canais (o canal de Na+ e o canal de K+ dependentes da voltagem). O canal de Na+ dependente da voltagem tem duas portas. Uma é a porta de ativação que se abre quando o potencial de membrana ultrapassa os -55 mV. A outra porta é a porta de inativação Quando uma célula está em repouso, a porta de ativação está fechada e a porta de inativação está aberta. No entanto, quando o limiar é atingido, a porta de ativação abre-se, permitindo que o Na+ entre na célula. No momento do pico da despolarização, a porta de inativação fecha-se. Durante a repolarização, o sódio deixa de poder entrarQuando o potencial de membrana ultrapassa novamente os -55 mV, a porta de ativação fecha-se. Depois disso, a porta de inativação volta a abrir-se, deixando o canal pronto para recomeçar todo o processo.
O canal de K+ controlado por voltagem tem apenas um portão, que é sensível a uma voltagem de membrana de -50 mV. No entanto, não abre tão rapidamente como o canal de Na+ controlado por voltagem. Pode demorar uma fração de milissegundo para o canal abrir quando essa voltagem é atingida. O momento em que isso acontece coincide exatamente com o pico do fluxo de Na+, pelo que os canais de K+ controlados por voltagem abrem precisamente quando os canais de Na+ controlados por voltagem abrem.À medida que o potencial de membrana se repolariza e a voltagem passa novamente para -50 mV, o canal fecha-se - novamente, com um pequeno atraso. O potássio continua a sair da célula por um curto período de tempo e o potencial de membrana torna-se mais negativo, resultando no overshoot de hiperpolarização. Em seguida, o canal fecha-se novamente e a membrana pode voltar ao potencial de repousodevido à atividade contínua dos canais não fechados e da bomba Na+/K+.
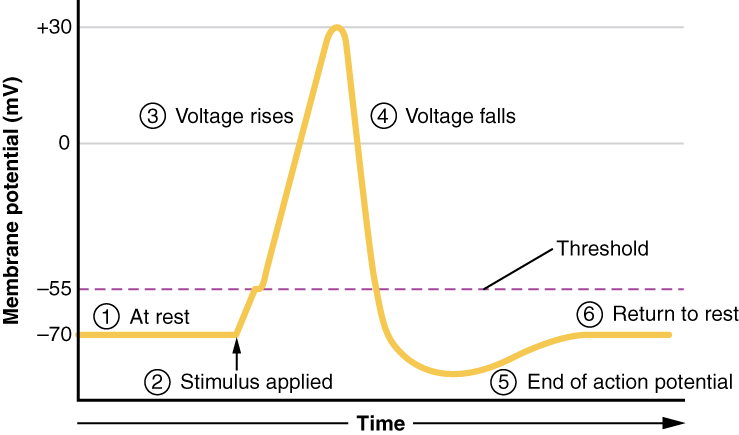
Figura 8. Fases de um potencial de ação
Tudo isto acontece em cerca de 2 milissegundos (Figura 8). Enquanto um potencial de ação está em curso, outro não pode ser iniciado. Este efeito é designado por período refratário Existem duas fases do período refratário: a período refratário absoluto e o período refratário relativo Durante a fase absoluta, não se iniciará outro potencial de ação, devido à porta de inativação do canal de Na+ com porta de voltagem. Quando o canal volta à sua conformação de repouso (menos de -55 mV), pode iniciar-se um novo potencial de ação, mas apenas com um estímulo mais forte do que o que iniciou o potencial de ação atual, devido ao fluxo de K+ para fora da célula.Como esse ião está a sair a correr, qualquer Na+ que tente entrar não despolarizará a célula, mas apenas evitará que a célula se hiperpolarize.
Traçando a tensão medida através da membrana celular em função do tempo (como se mostra na Figura 8), os eventos do potencial de ação podem ser relacionados com alterações específicas na tensão da membrana.
- Em repouso, a tensão da membrana é de -70 mV.
- A membrana começa a despolarizar-se quando é aplicado um estímulo externo.
- A tensão da membrana começa a subir rapidamente em direção a +30 mV.
- A tensão da membrana começa a regressar a um valor negativo.
- A repolarização continua para além da tensão de repouso da membrana, resultando em hiperpolarização.
- A voltagem da membrana regressa ao valor de repouso pouco tempo depois da hiperpolarização.
Propagação do potencial de ação
O potencial de ação é iniciado no início do axónio, no chamado segmento inicial. Existe uma elevada densidade de canais de Na+ dependentes de voltagem, de modo que a despolarização rápida pode ocorrer aqui. Ao longo do comprimento do axónio, o potencial de ação é propagado porque mais canais de Na+ dependentes de voltagem são abertos à medida que a despolarização se espalha. Esta propagação ocorre porque o Na+ entraÀ medida que o Na+ se desloca, ou flui, uma curta distância ao longo da membrana celular, a sua carga positiva despolariza um pouco mais a membrana celular. À medida que essa despolarização se espalha, abrem-se novos canais de Na+ dependentes de voltagem e mais iões entram na célula, espalhando a despolarização um pouco mais.
Uma vez que os canais de Na+ dependentes da voltagem são inactivados no pico da despolarização, não podem ser abertos novamente durante um breve período de tempo - o período refratário absoluto. Por este motivo, a propagação da despolarização em direção aos canais previamente abertos não tem qualquer efeito. O potencial de ação deve propagar-se em direção aos terminais do axónio; como resultado, a polaridade do neurónio é mantida, como mencionado acima.
A propagação, tal como descrita acima, aplica-se a axónios não mielinizados. Quando existe mielinização, o potencial de ação propaga-se de forma diferente. Os iões de sódio que entram na célula no segmento inicial começam a espalhar-se ao longo do comprimento do segmento do axónio, mas não existem canais de Na+ dependentes da voltagem até ao primeiro nó de Ranvier. Como não existe uma abertura constante destes canais ao longo do axónioA distância entre os nós é a distância ideal para manter a membrana ainda despolarizada acima do limiar no nó seguinte. À medida que o Na+ se espalha ao longo do interior da membrana do segmento do axónio, a carga começa a dissipar-se. Se o nó estivesse mais abaixo no axónio, essa despolarização teria caído demasiado para que o Na+Se os nós estivessem mais próximos uns dos outros, a velocidade de propagação seria mais lenta.
A propagação ao longo de um axónio não mielinizado é designada por condução contínua ao longo do comprimento de um axónio mielinizado, é condução salina A condução contínua é lenta porque há sempre canais de Na+ dependentes da voltagem a abrir e cada vez mais Na+ entra na célula. A condução saltatória é mais rápida porque o potencial de ação salta basicamente de um nó para o outro ( salgar = Juntamente com a mielinização do axónio, o diâmetro do axónio pode influenciar a velocidade de condução. Tal como a água corre mais depressa num rio largo do que num riacho estreito, a despolarização baseada no Na+ espalha-se mais depressa por um axónio largo do que por um estreito. Este conceito é conhecido como resistência e é geralmente verdadeiro para os fios eléctricos ou canalizações, tal como é verdadeiro para os axónios, embora as condições específicas sejam diferentes à escala dos electrões ou iões versus a água de um rio.
Desequilíbrios homeostáticos: Concentração de potássio
As células gliais, especialmente os astrócitos, são responsáveis pela manutenção do ambiente químico do tecido do SNC. As concentrações de iões no fluido extracelular são a base da forma como o potencial de membrana é estabelecido e das alterações na sinalização eletroquímica. Se o equilíbrio dos iões for perturbado, são possíveis resultados drásticos.
Normalmente, a concentração de K+ é mais elevada no interior do neurónio do que no exterior. Após a fase de repolarização do potencial de ação, os canais de fuga de K+ e a bomba Na+/K+ asseguram que os iões regressam aos seus locais originais. Na sequência de um acidente vascular cerebral ou de outro evento isquémico, os níveis de K+ extracelular são elevados. Os astrócitos na área estão equipados para eliminar o excesso de K+ para ajudar a bomba. Mas quando ose o nível de oxigénio estiver muito desequilibrado, os efeitos podem ser irreversíveis.
Nestes casos, os astrócitos podem tornar-se reactivos, o que prejudica a sua capacidade de manter o ambiente químico local. As células gliais aumentam de tamanho e os seus processos incham. Perdem a sua capacidade de tamponamento de K+ e a função da bomba é afetada, ou mesmo invertida. Se um gradiente de Na+ se rompe, isso tem um efeito mais importante do que a interrupção do potencial de ação. Transporte de glicoseQuando este se perde, a célula não consegue obter a energia de que necessita. No sistema nervoso central, o metabolismo dos hidratos de carbono é o único meio de produção de ATP. Noutras partes do corpo, as células dependem dos hidratos de carbono, dos lípidos ou dos aminoácidos para alimentar a produção de ATP mitocondrial. Mas o SNC não armazena lípidos nos adipócitos (células adiposas) como reserva de energia.Os lípidos no SNC encontram-se nas membranas celulares dos neurónios e das células gliais, nomeadamente como componente integral da mielina. As proteínas no SNC são cruciais para a função neuronal, em papéis como os canais de sinalização eléctrica ou como parte do citoesqueleto. Estas macromoléculas não são utilizadas para alimentar a produção de ATP mitocondrial nos neurónios.
Visite este site para ver um laboratório virtual de neurofisiologia e observar os processos electrofisiológicos no sistema nervoso, onde os cientistas medem diretamente os sinais eléctricos produzidos pelos neurónios. Muitas vezes, os potenciais de ação ocorrem tão rapidamente que não é útil ver um ecrã para os ver ocorrer. Um altifalante é alimentado pelos sinais registados de um neurónio e "estala" sempre que o neurónioEstes potenciais de ação disparam tão rapidamente que soam como estática no rádio. Os electrofisiologistas podem reconhecer os padrões dessa estática para compreender o que está a acontecer. Porque é que o modelo da sanguessuga é utilizado para medir a atividade eléctrica dos neurónios em vez de utilizar seres humanos?