- Definição do estado de oxidação do carbono
- Ler mais
- Oxidação e redução de compostos orgânicos - uma visão geral
Definição do estado de oxidação do carbono
Quando começamos a analisar as reacções redox orgânicas, é útil considerar a forma como definimos o estado de oxidação do carbono. A maioria das reacções redox neste capítulo envolve uma alteração no estado de oxidação do carbono que contém o grupo funcional. Para calcular o estado de oxidação do carbono, utilize as seguintes orientações:
- Numa ligação C-H, o H é tratado como se tivesse um estado de oxidação +1. Isto significa que todas as ligações C-H diminuir o estado de oxidação do carbono em 1.
- Para o carbono ligado a um não-metal X mais eletronegativo, como o azoto, o oxigénio, o enxofre ou os halogéneos, cada ligação C-X aumentar o estado de oxidação do carbono em 1. (Alguns não-metais são menos electronegativos do que o carbono, como o fósforo, o silício ou o boro, mas as ligações do carbono a estes elementos são muito menos comuns).
- Para o carbono ligado a outro carbono, o estado de oxidação não é afetado. Assim, um carbono ligado a 4 carbonos tem um estado de oxidação zero.
Assim, ao contrário dos metais, que se encontram quase sempre num estado de oxidação positivo, o estado de oxidação do carbono pode variar muito, de -4 (no CH4) a +4 (como no CO2). Eis alguns exemplos.
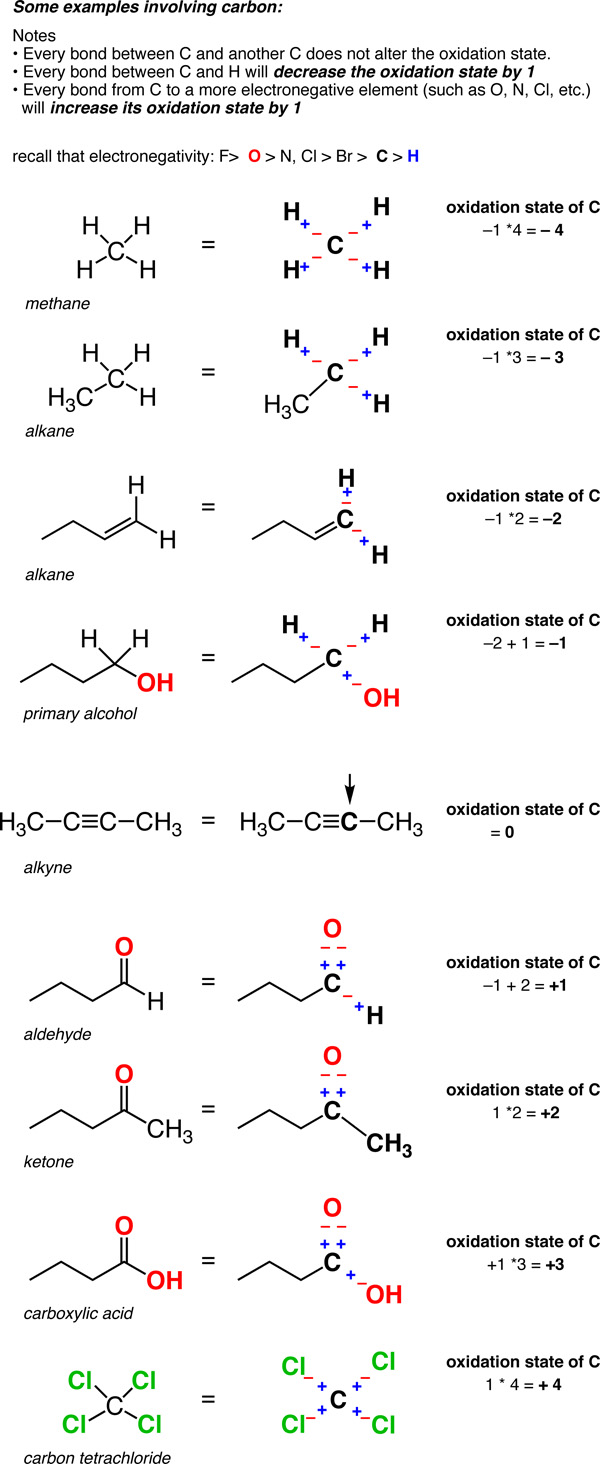
(Não se esqueça que isto é chamado de "formalismo" por uma razão. A carga no carbono não é realmente +Mas o formalismo do estado de oxidação ajuda-nos a saber para onde vão os electrões, o que será útil muito em breve).
Com a compreensão de como calcular os estados de oxidação do carbono, estamos prontos para o passo seguinte: compreender alterações no estado de oxidação do carbono, através de reacções conhecidas como oxidações (em que o estado de oxidação é aumentado), e reduções (Mais sobre isso na próxima vez.
Ler mais
A escada de oxidação
Referências
- //www.masterorganicchemistry.co...e-of-a-carbon/
Contribuintes
- James Ashenhurst (MasterOrganicChemistry.com)
Oxidação e redução de compostos orgânicos - uma visão geral
Sem dúvida que já está familiarizado com a ideia geral de oxidação e redução: aprendeu em química geral que quando um composto ou átomo é oxidado perde electrões e quando é reduzido ganha electrões. Sabe também que as reacções de oxidação e redução ocorrem em pares: se uma espécie é oxidada, outra tem de ser reduzida ao mesmo tempo - daí o termo "redoxA maioria das reacções redox que viu anteriormente em química geral envolveu provavelmente o fluxo de electrões de um metal para outro, tal como a reação entre o ião cobre em solução e o zinco metálico:
\[Cu^{+2}_{(aq)} + Zn_{(s)} \rightarrow Cu_{(s)} + Zn^{+2}_{(aq)} \tag{16.1.1}\]
Na química orgânica, as reacções redox têm um aspeto um pouco diferente. Os electrões numa reação redox orgânica são frequentemente transferidos sob a forma de um ião hidreto - um protão e dois electrões. Uma vez que ocorrem em conjunto com a transferência de um protão, são normalmente designados por hidrogenação e desidrogenação reacções: um hidreto mais um protão dá origem a um hidrogénio (H 2 ) molécula. cuidado - não confundir os termos hid rogénio ação e desidratação drogénio A hidratação e a desidratação - estas últimas referem-se ao ganho e à perda de um água molécula (e são não reacções redox), enquanto as primeiras se referem ao ganho e perda de um hidrogénio molécula.
Quando um átomo de carbono de um composto orgânico perde uma ligação ao hidrogénio e ganha uma nova ligação a um heteroátomo (ou a outro carbono), dizemos que o composto foi desidrogenado ou oxidado. Um exemplo bioquímico muito comum é a oxidação de um álcool em cetona ou aldeído:
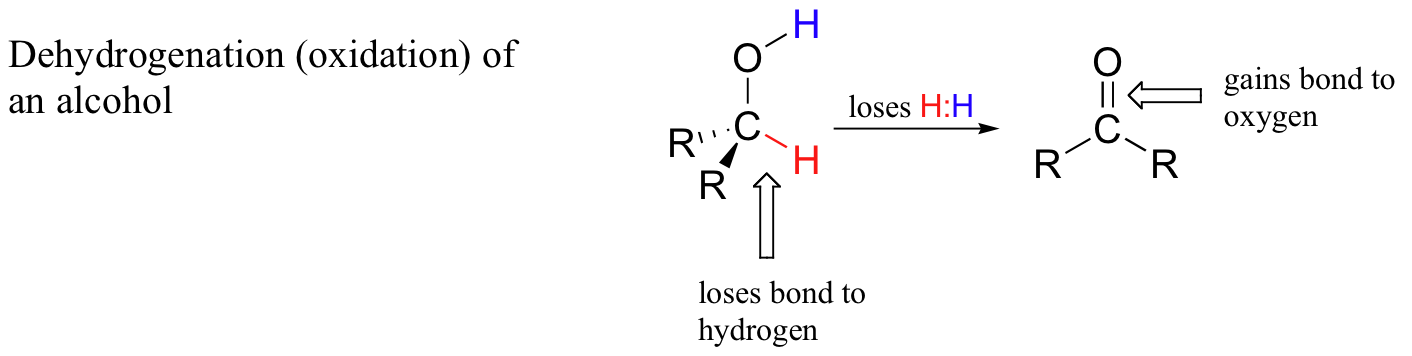
Quando um átomo de carbono perde uma ligação ao hidrogénio e ganha uma ligação a um heteroátomo (ou a outro átomo de carbono), considera-se que se trata de um processo oxidativo porque o hidrogénio, de todos os elementos, é o menos eletronegativo. Assim, no processo de desidrogenação, o átomo de carbono sofre uma perda global de densidade eletrónica - e a perda de electrões é a oxidação.
Por outro lado, quando um átomo de carbono de um composto orgânico ganha uma ligação ao hidrogénio e perde uma ligação a um heteroátomo (ou a outro átomo de carbono), dizemos que o composto foi hidrogenado ou reduzido. A hidrogenação de uma cetona a um álcool, por exemplo, é globalmente o inverso da desidrogenação do álcool acima apresentada. Abaixo está ilustrada outra possibilidade comum, a hidrogenação(redução) de um alceno a um alcano.
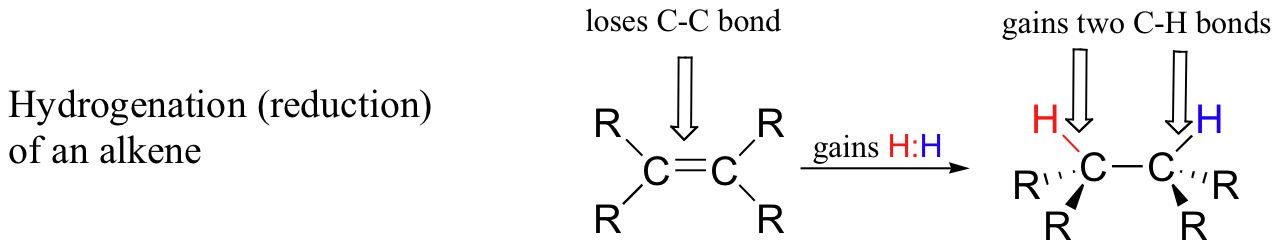
A hidrogenação resulta em superior densidade eletrónica num átomo(s) de carbono, pelo que consideramos o processo como sendo de redução da molécula orgânica.
Note-se que nem a hidrogenação nem a desidrogenação envolvem o ganho ou a perda de um oxigénio átomo Reacções que fazer que envolvem o ganho ou a perda de um ou mais átomos de oxigénio são normalmente designadas por reacções de "oxigenase" e "redutase".
Na maior parte das vezes, quando falamos de reacções redox em química orgânica, estamos a lidar com um pequeno conjunto de transformações de grupos funcionais muito reconhecíveis. Por isso, vale muito a pena familiarizarmo-nos com a ideia de "estados de oxidação" aplicada a grupos funcionais orgânicos. Comparando o número relativo de ligações a átomos de hidrogénio, podemos ordenar os grupos funcionais familiaresO metano, com quatro ligações carbono-hidrogénio, é altamente reduzido. O próximo na série é o metanol (menos uma ligação carbono-hidrogénio, mais uma ligação carbono-oxigénio), seguido do formaldeído, do formato e, finalmente, do dióxido de carbono, no extremo altamente oxidado do grupo.
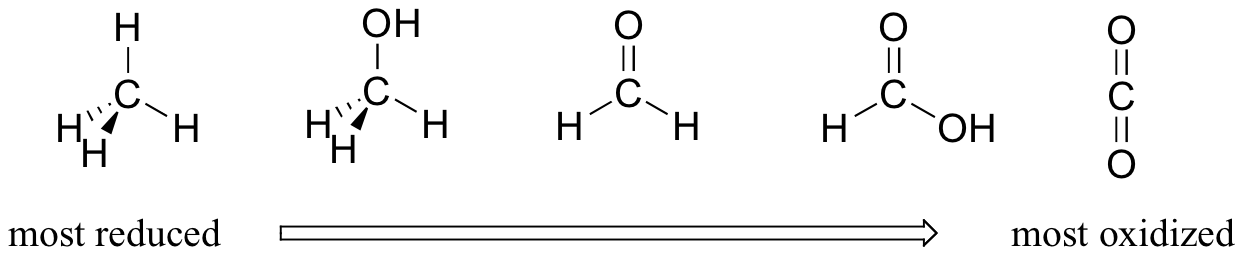
Este padrão é verdadeiro para os grupos funcionais relevantes em moléculas orgânicas com dois ou mais átomos de carbono:
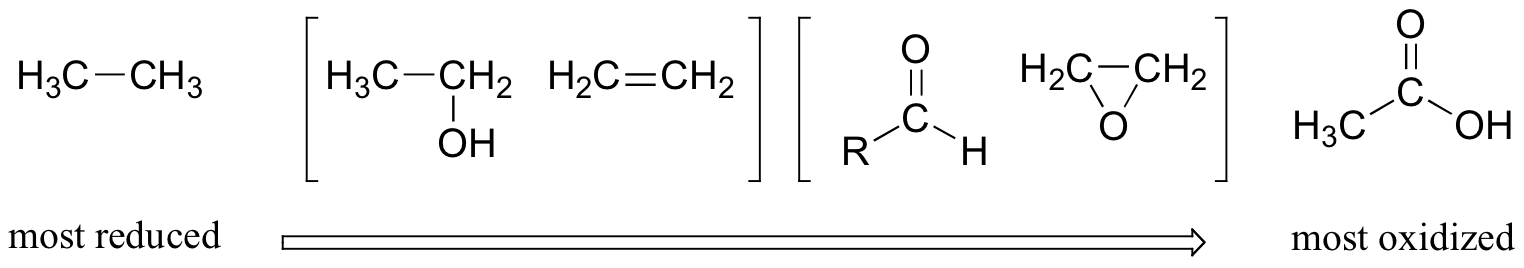
Os alcanos são altamente reduzidos, enquanto os álcoois - bem como os alcenos, éteres, aminas, sulfuretos e ésteres de fosfato - estão um degrau acima na escala de oxidação, seguidos pelos aldeídos/cetonas/iminas e epóxidos e, finalmente, pelos derivados de ácidos carboxílicos (o dióxido de carbono, no topo da lista de oxidação, é específico da série de carbono único).
Repare que, na série de compostos de dois carbonos acima, o etanol e o eteno são considerados como estando no mesmo estado de oxidação. Já sabe que os álcoois e os alcenos são interconvertidos por adição ou eliminação de água (por exemplo, na secção 10.4.). Quando um álcool é desidratado para formar um alceno, um dos dois carbonos perde uma ligação C-H e ganha uma ligação C-C, sendo assim oxidado.No entanto, o outro carbono perde uma ligação C-O e ganha uma ligação C-C, pelo que é considerado reduzido. Globalmente, portanto, não há alteração do estado de oxidação dos carbonos considerados em conjunto.
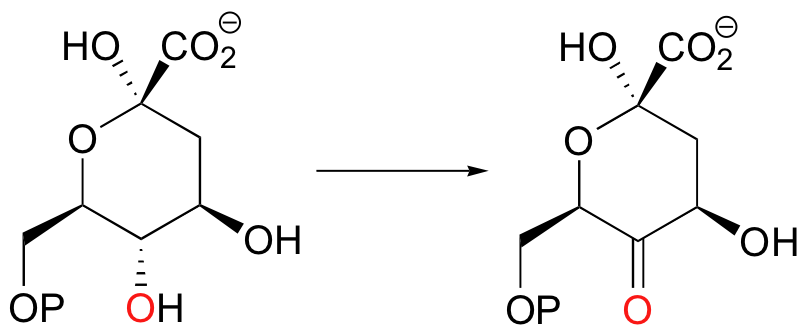
Deve aprender a reconhecer quando uma reação envolve uma mudança no estado de oxidação dos carbonos de um reagente orgânico. Olhando para a seguinte transformação, por exemplo, deve ser capaz de reconhecer rapidamente que se trata de uma oxidação: um grupo funcional álcool é convertido numa cetona, que está um degrau acima na escada de oxidação.
Do mesmo modo, esta reação seguinte envolve a transformação de um derivado de ácido carboxílico (um tioéster) primeiro num aldeído e depois num álcool: trata-se de uma duplo redução, uma vez que o substrato perde duas ligações aos heteroátomos e ganha duas ligações aos hidrogénios.

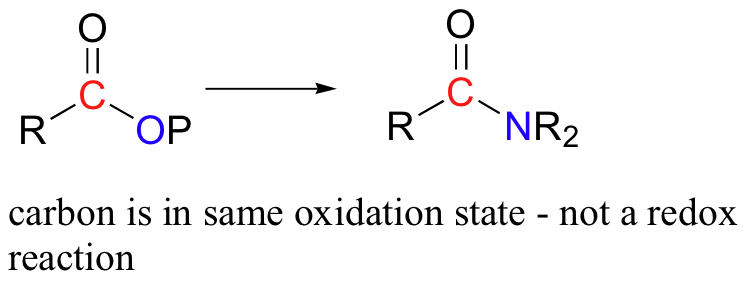
Uma reação de transferência de acilo (por exemplo, a conversão de um acilfosfato numa amida) é não considerada uma reação redox - o estado de oxidação da molécula orgânica não se altera à medida que o substrato é convertido em produto, porque uma ligação a um heteroátomo (oxigénio) foi simplesmente trocada por uma ligação a outro heteroátomo (azoto).
É importante ser capaz de reconhecer quando uma molécula orgânica está a ser oxidada ou reduzida, porque esta informação diz-lhe para procurar a participação de um agente redox correspondente que está a ser reduzido ou oxidado - lembre-se, a oxidação e a redução ocorrem sempre em conjunto! Em breve aprenderemos em pormenor sobre os agentes redox bioquímicos e laboratoriais mais importantes.
- Química Orgânica com Ênfase em Biologia por Tim Soderberg (Universidade de Minnesota, Morris)
